
物质中杂质(括号内为杂质)的检验、除杂的试剂或方法都正确的是( )
| 物质及其杂质 | 检验 | 除杂 | |
| A | Cl2(HCl) | 湿润的淀粉KI试纸 | 饱和食盐水 |
| B | NO(NO2) | 观察颜色或湿润的淀粉KI试纸 | 水 |
| C | CO2(HCl) | AgNO3溶液(含稀硝酸) | 饱和Na2CO3溶液 |
| D | NaHCO3溶液(Na2CO3) | Ca(OH)2溶液 | 过量CO2 |
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )
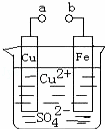
|
| A. | a和b不连接时,铁片上会有金属铜析出 |
|
| B. | a和b用导线连接时,铜片上发生的反应为:Cu2++2e﹣=Cu |
|
| C. | 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
|
| D. | a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学用语正确的是( )
|
| A. | 氯化钠的电子式:Na: |
|
| B. | 乙烯的结构简式:C2H4 |
|
| C. | 硅的原子结构示意图: |
|
| D. | 硫酸的电离方程式:H2SO4=H22++SO42 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下,浓度均为0.1mol•L﹣1的4种钠盐溶液pH如下表:下列说法中正确的是( )
| 溶质 | Na2CO3 | NaClO | NaHCO3 | NaHSO3 |
| pH | 11.6 | 10.3 | 8.3 | 5.2 |
|
| A. | 足量SO2通入NaClO溶液中发生反应的离子方程式为:H2O+SO2+ClO﹣=HClO+HSO3﹣ |
|
| B. | 向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度 |
|
| C. | 常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,pH最大的是H2SO3 |
|
| D. | NaHSO3溶液中离子浓度大小顺序为:c(Na+)>c(H+)>c(HSO3﹣)>c(SO32﹣)>c(OH﹣) |
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,机动车废气排放已成为城市大气污染的重要来源.
(1)在汽车尾气系统中安装催化转换器,可有效减少尾气中的CO、NOx 和碳氢化合物等废气.
已知:N2(g)+O2(g)=2NO(g)△H1=+180kJ/mol
CO(g)+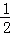 O2(g)=CO2(g)△H2=﹣283kJ/mol
O2(g)=CO2(g)△H2=﹣283kJ/mol
2NO(g)+2CO(g)=2CO2(g)+N2(g)△H3则△H3= kJ•mol﹣1.
(2)气缸中生成NO的反应为:N2(g)+O2(g)═2NO(g)△H>0
①汽车启动后,气缸内温度越高,单位时间内NO排放量越大,原因是 .
②1mol空气中含有0.8molN2和0.2molO2,1300℃时在含1mol空气的密闭容器内反应达到平衡,测得NO为8×10﹣4mol.计算该温度下的平衡常数K≈ .
(3)尾气中的CO主要来自于汽油不完全燃烧.
①有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)△H=+221kJ•mol﹣1,简述该设想能否实现的依据:
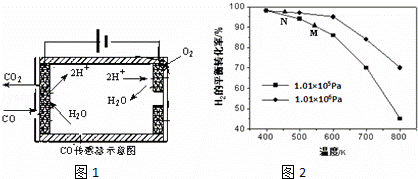
②测量汽车尾气的浓度常用电化学气敏传感器,其中CO传感器可用如图1简单表示,则阳极发生的电极反应为 .
(4)汽车尾气中的CO可转化为甲烷,方程式为CO(g)+3H2(g)⇌CH4(g)+H2O(g).其他条件相同时,H2的平衡转化率在不同压强下随温度的变化如图2所示.
①该反应的△H 0(填“<”、“=”或“>”).
②实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由 .
查看答案和解析>>
科目:高中化学 来源: 题型:
高锰酸钾是常用的氧化剂。工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体。中间产物为锰酸钾。下图是实验室模拟制备的操作流程:

相关资料:
①物质溶解度
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
②锰酸钾
外观性状:墨绿色结晶。其水溶液呈深绿色,这是锰酸根(MnO42—)的特征颜色。
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42—会发生歧化反应。
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是______________;
实验中用铁坩埚煅烧暴露在空气中的固体混合物发生反应的化学方程式为_______。
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低。请写出实验中通入适量CO2时体系中可能发生反应离子方程式 : ;
其中氧化还原反应中氧化剂和还原剂的质量比为_________________________。
(3)由于CO2的通人量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸。从理论上分析,选用下列酸中________ ,得到的产品纯度更高。
A.醋酸 B.浓盐酸 C.稀硫酸
 (4)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式_______________________________________;
(4)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式_______________________________________;
传统工艺采用无膜电解法由于副反应发生,Mn元素利用率和电流效率都会偏低。有同学联想到离子交换膜法电解饱和食盐水提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图)。
图中A口加入的溶液最好为__________。
使用阳离子交换膜可以提高Mn元素利用率的原因为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在298 K时,实验测得溶液中的反应:H2O2+2HI====2H2O+I2,在不同浓度时的化学反应速率见下表,由此可推知当c(HI)=0.500 mol·L-1,c(H2O2)=0.400 mol·L-1时的反应速率为( )
| 实验编号 | 1 | 2 | 3 | 4 | 5 |
| c(HI)/mol·L-1·min-1 | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
| c(H2O2)/mol·L-1·min-1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
| v/mol·L-1·s-1 | 0.007 60 | 0.015 3 | 0.022 7 | 0.015 1 | 0.022 8 |
A.0.038 0 mol·L-1·s-1 B.0.152 mol·L-1·s-1
C.0.608 mol·L-1·s-1 D.0.760 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是(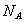 代表阿伏加德罗常数值)
代表阿伏加德罗常数值)
A. 1molNa被完全氧化为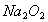 ,失去的电子数为2
,失去的电子数为2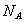
B. 常温常压下,16g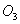 气体含有氧原子数为
气体含有氧原子数为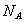
C. 常温常压下,22.4L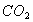 含有的分子数为
含有的分子数为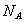
D. 18g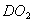 所含的电子数为10
所含的电子数为10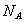
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素A、B、C在元素周期表中的位置如图所示。已知B、C两元素所在族数之和是A元素族数的2倍,B、C两元素的原子序数之和是A元素的4倍,则A、B、C是 ( )
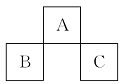
A.Be、Na、Al B.B、Mg、Si
C.O、P、Cl D.C、Al、P
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com