
(11分)下图是中学化学的一个重要定量实验过程示意图,回答下列问题:
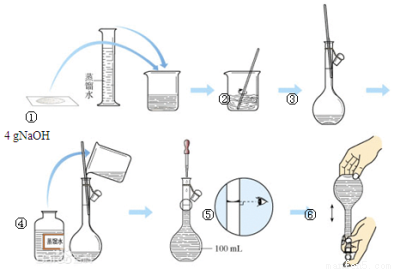
(1)该实验中的一处错误是 。
(2)该实验中,能较精确确定液体体积的两种玻璃仪器是 、 。
(3)操作过程中多次用到玻璃棒,请分别说明它们在实验中的作用:操作②中 、操作③中 。
(4)不规范的实验操作会导致实验结果出现误差,分析下列操作对实验结果的影响(填“偏大”、“偏小”或“无影响”)。
a.在第②步操作中,有少量液体溅出烧杯外: 。
b.在第③步操作中,容量瓶内本来有少量水: 。
c.在第⑤步操作中,若俯视刻度线: 。
d.在第⑥步操作中,经振荡、摇均、静置后发现液面低于刻度线,再加蒸馏水至刻度线: 。
(5)若操作全部正确,最后所得的溶液应存放在试剂瓶中,并贴上标签,请填写标签上的内容(如图) 。
[第(5)小题2分,其余每空1分,共11分]
(1)NaOH不能用称量纸称量(或NaOH应在小烧杯中称量)
(2)量筒、100 mL容量瓶
(3)搅拌、引流。
(4)偏小、无影响、偏大、偏小
(5)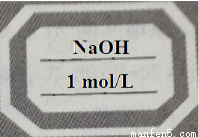
【解析】
试题分析:(1)该实验中的一处错误是图①中氢氧化钠易吸潮,应在称量瓶或小烧杯中称量,不能在纸上称量;(2)量筒和容量瓶都是量器,能准确量取溶液的体积。(3)玻璃棒,在实验操作②溶解中起到搅拌作用、在实验操作③转移中起到引流的作用;(4)a.在第②步操作中,有少量液体溅出烧杯外,溶质的物质的量减小,溶液浓度偏小;b.在第③步操作中,容量瓶内本来有少量水对溶液浓度没有影响;c.在第⑤步操作中,若俯视刻度线,溶液的体积偏小,浓度偏大;d.在第⑥步操作中,经振荡、摇均、静置后发现液面低于刻度线,再加蒸馏水至刻度线,溶液体积增大,浓度偏低;(5)标签上应注明溶液的名称及溶液的浓度,4g氢氧化钠配成100ml溶液,浓度为1mol/L。
考点:一定物质的量浓度的溶液的配制


科目:高中化学 来源:2014-2015学年宁夏回族自治区银川一中高二上学期期中化学试卷(解析版) 题型:填空题
(12分)反应m A+n B p C+q D在某温度下达到平衡。
p C+q D在某温度下达到平衡。
①若A、B、C、D都是气体,保持温度不变,将气体体积压缩到原来的一半,当再次达到平衡时C的物质的量浓度变为原来的1.8倍,则m、n、p ,q的关系是_____________。
②若A、B、C、D都为气体,且m+ n = p+ q,则将气体体积压缩后A的物质的量将_________(填“减小”“增大”“不变”),平衡必定______移动。(填“正向”或“逆向”或“不”)
③若给体系升温, B的物质的量减少,则正反应为 ________反应(填“放热”“吸热”)
④若在体系中增加A的量,平衡不发生移动,则A肯定不能为_____态
⑤若加正催化剂,则反应物的转化率将________(填“减小”“增大”“不变”)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏回族自治区银川一中高二上学期期中化学试卷(解析版) 题型:选择题
一定条件下,对于可逆反应X(g)+3Y(g)?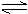 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是
A.c1的取值范围为0 mol·L-1<c1<0.14 mol·L-1
B.平衡时,Y和Z的生成速率之比为2∶3
C.X、Y的转化率不相等
D.c1∶c2=3∶1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏回族自治区银川一中高二上学期期中化学试卷(解析版) 题型:选择题
某反应4A(g)+5B(g)=4C(g)+6D(g),在四种不同情况下的反应速率分别为:
①υ(A)=0.4mol/(L·s);②υ(B)=0.6mol/(L·s);
③υ(C)= 0.8mol/(L·s);④υ(D)=1.0mol/(L·min)。该反应进行得最快的是
A.④ B.③ C.②③ D.①④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏高邮市高一上学期期中调研测试化学试卷(解析版) 题型:选择题
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A.氯水的颜色呈浅绿色,说明氯水中含有Cl2
B.向氯水中滴加稀硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏高邮市高一上学期期中调研测试化学试卷(解析版) 题型:选择题
下列说法中不正确的是
A.在非标准状况下,1 mol O2的体积也有可能是22.4 L
B.在温度和压强一定时,气态物质的体积主要由气体分子数目和分子的大小决定
C.同温同压下,0.3 mol N2和0.7 mol O2的体积比为3∶7
D.同温同压下,相同体积的任何气体所含有的分子数目一定相同
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省高二上学期期中化学试卷(解析版) 题型:选择题
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可作空军通信卫星的电源,其工作原理如下图所示,

下列说法正确的是
A.每消耗3mol H2O2,转移的电子为3mol
B.电池放电时,Na+从a极区移向b极区
C.电极a采用MnO2,MnO2既作电极材料又有催化作用
D.该电池的负极反应为BH4-+2H2O-8e-=BO2-+8H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com