
| A、证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾--淀粉试纸检验,观察试纸颜色的变化 |
| B、铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,铝热剂中一定不含铁的氧化物 |
| C、将SO2通入Ba(NO3)2溶液,有白色沉淀生成,证明BaSO3难溶于硝酸 |
| D、在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,验证Na2CO3溶液中存在水解平衡 |


科目:高中化学 来源: 题型:
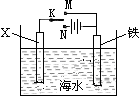 已知海水中含有的离子主要有Na+、Mg2+、Cl-、Br-,利用如图装置进行实验探究,下列说法正确的是( )
已知海水中含有的离子主要有Na+、Mg2+、Cl-、Br-,利用如图装置进行实验探究,下列说法正确的是( )| A、X为锌棒,K置于M,可减缓铁的腐蚀,铁电极上发生的反应为2H++2e-=H2↑ |
| B、X为锌棒,K置于M,外电路电流方向是从X到铁 |
| C、X为碳棒,K置于N,可减缓铁的腐蚀,利用的是外加电流的阴极保护法 |
| D、X为碳棒,K置于N,在X电极周围首先失电子的是Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、体积比为11:8 |
| B、分子个数之比为1:1 |
| C、物质的量之比为11:8 |
| D、原子个数之比为12:11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
| B、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| C、AlCl3溶液中加入过量的浓氨水:Al3++4NH3?H2O→AlO2-+4NH4++2H2O |
| D、H2SO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
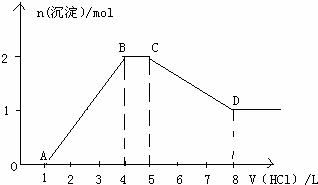
| 阴离子种类 | |||||
| 物质的量浓度(mol/L) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在一定温度下,AgCl水溶液中Ag+和Cl-浓度的乘积是一个常数 |
| B、催化剂都不参与化学反应,反应前后质量、组成和性质都保持不变 |
| C、应用盖斯定律,可间接计算某些难以直接测量的反应热 |
| D、由于分子间氢键的存在,第VA族氢化物的沸点大小关系为:NH3>SbH3>AsH3>PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com