
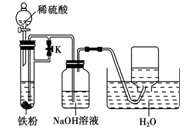
 Fe3O4+4H2↑
Fe3O4+4H2↑  Fe3O4+4H2↑
Fe3O4+4H2↑ 

科目:高中化学 来源:不详 题型:实验题
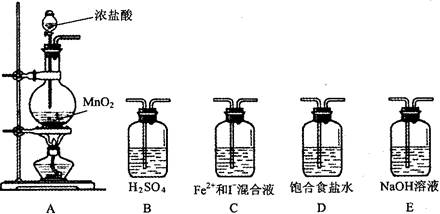
| 实验步骤 | 预期现象和结论 |
| 取少量反应后的混合溶液分置于A、B两试管中; 往A中滴加__________溶液 往B中滴加__________溶液 | ①若_______________________________ ________________________,则假设1成立 ②若____________________________ ________________________,则假设2成立 ③若______________________________ ______________________,则假设3成立 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | 0.1MPa | 0.5MPa[ | 1 MPa | 10 MPa |
| 400℃ | 99.2% | 99.6%[ | 99.7% | 99.9% |
| 500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
| 600℃ | 73.7% | 85.8% | 89.5% | 96.4% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
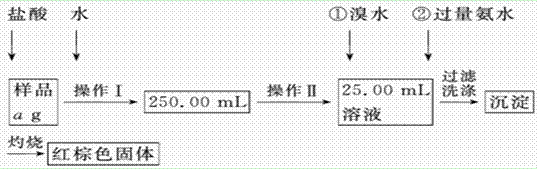
| A.50 mL烧杯 | B.50 mL量筒 | C.100 mL量筒 | D.25 mL滴定管 |
 生的离子反应方程式
生的离子反应方程式 ________________________,加入氨水要过量的原因是___________________________。
________________________,加入氨水要过量的原因是___________________________。 _
_ _________________
_________________ _______________________________________________。
_______________________________________________。 量准确,最终测量的结果偏大,则造成误差的原因可能是___________________________
量准确,最终测量的结果偏大,则造成误差的原因可能是___________________________查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
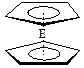
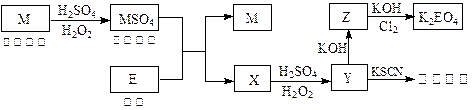
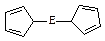 。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。
。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
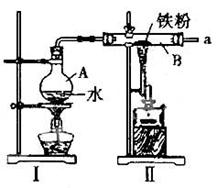
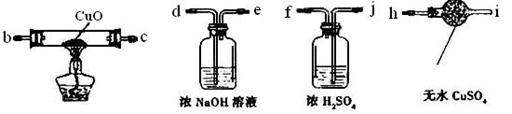
科目:高中化学 来源:不详 题型:实验题
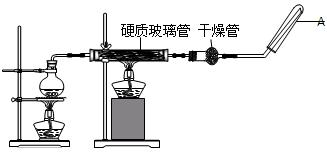
 。
。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com