
 A、B、C、D、E、F、G为前四周期元素.A、B最外层电子排布可表示为asa、bsbbpb(a≠b);C元素对应单质是空气中含量最多的物质;D的最外层电子数是内层电子数的3倍;E与D同主族,且位于D的下一周期;F与E同周期,且是本周期中电负性最大的元素:基态G原子核外电子填充在7个能级中,且价层电子均为单电子.
A、B、C、D、E、F、G为前四周期元素.A、B最外层电子排布可表示为asa、bsbbpb(a≠b);C元素对应单质是空气中含量最多的物质;D的最外层电子数是内层电子数的3倍;E与D同主族,且位于D的下一周期;F与E同周期,且是本周期中电负性最大的元素:基态G原子核外电子填充在7个能级中,且价层电子均为单电子. .
.分析 A、B、C、D、E、F、G为前四周期元素.A、B最外层电子排布可表示为asa、bsbbpb(a≠b),B的最外层电子排布bsbbpb中p轨道有电子,则s轨道一定排满,即b=2,所以B的最外层电子排布2s22p2,则B为C元素,s轨道最多排两个电子,已知a≠b,则a=1,所以A的最外层电子排布为1s1,即A为H元素;C元素对应单质是空气中含量最多的物质,则C为N元素;D的最外层电子数是内层电子数的3倍,则D含有8个电子,即D为O元素;E与D同主族,且位于D的下一周期,则E为S元素;F与E同周期,且是本周期中电负性最大的元素,则F位于第三周期第VIIA族,为Cl元素;基态G原子核外电子填充在7个能级,且价层电子均为单电子,即电子排布式为1s22s22p63s23p63d54s1,则G为Cr元素,以此来解答.
解答 解:A、B、C、D、E、F、G为前四周期元素.A、B最外层电子排布可表示为asa、bsbbpb(a≠b),B的最外层电子排布bsbbpb中p轨道有电子,则s轨道一定排满,即b=2,所以B的最外层电子排布2s22p2,则B为C元素,s轨道最多排两个电子,已知a≠b,则a=1,所以A的最外层电子排布为1s1,即A为H元素;C元素对应单质是空气中含量最多的物质,则C为N元素;D的最外层电子数是内层电子数的3倍,则D含有8个电子,即D为O元素;E与D同主族,且位于D的下一周期,则E为S元素;F与E同周期,且是本周期中电负性最大的元素,则F位于第三周期第VIIA族,为Cl元素;基态G原子核外电子填充在7个能级,且价层电子均为单电子,即电子排布式为1s22s22p63s23p63d54s1,则G为Cr元素,
(1)电子排布为全满或半满状态时,原子较稳定,元素的第一电离能较大,所以元素C、N、O的第一电离能由大到小的顺序为N>O>C;
故答案为:N>O>C;
(2)SO3分子中S的价层电子对数为3+$\frac{1}{2}$(6-2×3)=3,没有孤电子对,则空间构型为平面三角形,的空间构型为平面三角形,中心原子的杂化方式为sp2;
故答案为:平面三角形;sp2;
(3)四种分子①CH4为正四面体,键角为109°28′;②SO3为平面三角形,键角为120°,③H2O为V形,键角为105°;④NH3为三角锥形,键角为107°;
所以键角由大到小排列的顺序是②>①>④>③;
故答案为:②>①>④>③;
(4)NH3分子为三角锥形,键角为107°,NH4+离子为正四面体,键角为109°28′,则这个过程中发生改变的是微粒的空间构型和A-C-A的键角;
故答案为:ac;
(5)原子总数、价电子总数相同的微粒互为等电子体,与SCN-互为等电子体的分子为CS2或CO2,SCN-中各原子的连接顺序为S-C-N,S与C形成一对共用电子对,C与N形成三对共用电子对,SCN-得到的一个电子给了S,故SCN-的电子式 ;
;
故答案为:CS2或CO2; ;
;
(6)Cr的电子排布式为电子排布式为1s22s22p63s23p63d54s1,其价层电子排布式为3d54s1;化合物[Cr(NH3)6]Cl3的中心离子的配位数为6;
故答案为:3d54s1;6;
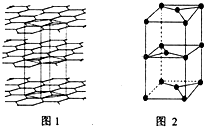
(7)①每个六元环含有C原子个数是2,每个C-C被两个环共用,则每个环中含有3个C-C键,所以C原子数、C-C键数、六元环数之比为2:3:1;
故答案为:2:3:1;
②该晶胞的上面可以分为2个三角形,如图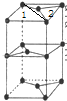 ,三角形1为等腰三角形,两个边长为acm,其底边长为2×a×sin60°=$\sqrt{3}$a,三角形2为等边三角形,底边边长为$\sqrt{3}$acm,则两个三角形的面积为$\frac{1}{2}$×$\sqrt{3}$a×$\sqrt{{a}^{2}-(\frac{\sqrt{3}}{2}a)^{2}}$+$\frac{1}{2}$×$\sqrt{3}$a×$\sqrt{(\sqrt{3}a)^{2}-(\frac{\sqrt{3}}{2}a){\;}^{2}}$=$\frac{\sqrt{3}}{2}$a2,所以晶胞的体积为$\frac{\sqrt{3}}{2}$a2×h═$\frac{\sqrt{3}}{2}$a2hcm3,
,三角形1为等腰三角形,两个边长为acm,其底边长为2×a×sin60°=$\sqrt{3}$a,三角形2为等边三角形,底边边长为$\sqrt{3}$acm,则两个三角形的面积为$\frac{1}{2}$×$\sqrt{3}$a×$\sqrt{{a}^{2}-(\frac{\sqrt{3}}{2}a)^{2}}$+$\frac{1}{2}$×$\sqrt{3}$a×$\sqrt{(\sqrt{3}a)^{2}-(\frac{\sqrt{3}}{2}a){\;}^{2}}$=$\frac{\sqrt{3}}{2}$a2,所以晶胞的体积为$\frac{\sqrt{3}}{2}$a2×h═$\frac{\sqrt{3}}{2}$a2hcm3,
一个晶胞中含有C原子数为$\frac{1}{8}$×8+$\frac{1}{2}$×2=2,则晶胞的质量为$\frac{12×2}{N{\;}_{A}}$g,所以密度为ρ=$\frac{m}{V}$=$\frac{\frac{24}{NA}}{\frac{\sqrt{3}}{2}{a}^{2}h}$=$\frac{16\sqrt{3}}{3{a}^{2}h{N}_{A}}$g/cm3;
故答案为:$\frac{16\sqrt{3}}{3{a}^{2}h{N}_{A}}$.
点评 本题是对物质结构与性质的考查,涉及元素推断、核外电子排布、第一电离能、分子构型、化学键、杂化方式、电子式、晶胞计算等,注意对基础知识的理解掌握,难度中等,需要学生具备扎实的基础与分析解决问题能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后SO2有剩余 | |
| B. | 溶液还可吸收SO2 | |
| C. | 溶液中除OH-外,只存在一种阴离子 | |
| D. | 溶液中溶质(正盐与酸式盐)的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| H2O | H2S | H2Se | H2Te |
| 100℃ | -60.75℃ | -41.5℃ | -1.8℃ |
| A. | 氧族元素氢化物沸点高低与范德华力的大小无关 | |
| B. | 范德华力一定随相对分子质量的增大而减小 | |
| C. | 水分子间可能还存在一种特殊的分子间作用力 | |
| D. | 水分子间存在共价键,加热时较难断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L壬烷中含有的氢原子的数目为10NA | |
| B. | 标准状况下,38.5克四氯化碳中氯原子数为NA | |
| C. | 标准状况下,2.24升辛烷完全燃烧生成二氧化碳分子数为0.8NA | |
| D. | 标准状况下,22.4升C3H6一定含有NA个碳碳双键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com