
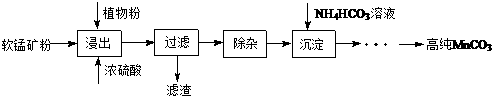
分析 湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰,加入浓硫酸和植物粉浸出过滤得到滤液除去杂质,加入碳酸氢铵形成沉淀通过一系列操作得到高纯碳酸锰,
(1)加入植物粉是一种还原剂;
(2)使用碳酸锰调pH的优势是不引入新的杂质;二氧化锰氧化过氧化氢为氧气,本身被还原为锰离子;
(3)依据碳酸氢铵受热易分解分析,在30℃~35℃下,将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀,硫酸铵,二氧化碳和水,生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是取最后一次洗涤液检验是否含有硫酸根离子设计;
(4)Ksp (MnCO3)=c(Mn2+)•c(CO32-),当Mn2+沉淀完全时,c(CO32-)=1.8×10-11/1.0×10-5=1.8×10-6 mol•L-1,若Mg2+也能形成沉淀,则要求Mg2+>2.6×10-5/1.8×10-6=14.4 mol•L-1,Mg2+的浓度0.01mol/L远小于14.4 mol•L-1.
解答 解:湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰,加入浓硫酸和植物粉浸出过滤得到滤液除去杂质,加入碳酸氢铵形成沉淀通过一系列操作得到高纯碳酸锰,
(1)在浸出液中加入植物粉起到了还原剂的作用,
故答案为:作还原剂;
(2)使用碳酸锰调pH的优势是不引入新的杂质;酸性溶液中二氧化锰氧化过氧化氢为氧气,本身被还原为锰离子,反应的离子方程式为:MnO2+H2O2+2H+=Mn2++2H2O+O2↑,
故答案为:增加MnCO3的产量(或不引入新的杂质等);MnO2+H2O2+2H+=Mn2++2H2O+O2↑;
(3)依据碳酸氢铵受热易分解分析,温度控制35℃以下的原因是防止碳酸氢铵分解,在30℃~35℃下,将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀,硫酸铵,二氧化碳和水,反应的化学方程式为:MnSO4+2NH4HCO3$\frac{\underline{\;30℃-35℃\;}}{\;}$MnCO3↓+(NH4)2SO4+CO2↑+H2O,生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是取最后一次洗涤液检验是否含有硫酸根离子设计,取最后一次的洗涤滤液1~2 mL 于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净,
故答案为:减少碳酸氢铵的分解,提高原料利用率;MnSO4+2NH4HCO3$\frac{\underline{\;30℃-35℃\;}}{\;}$MnCO3+(NH4)2SO4+CO2↑+H2O;取最后一次的洗涤滤液1~2 mL 于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净;
(4)Ksp (MnCO3)=c(Mn2+)•c(CO32-),当Mn2+沉淀完全时,c(CO32-)=$\frac{1.8×1{0}^{-11}}{1.0}$×10-5=1.8×10-6 mol•L-1,若Mg2+也能形成沉淀,则要求Mg2+>2.6×10-5/1.8×10-6=14.4 mol•L-1,Mg2+的浓度0.01mol/L远小于14.4 mol•L-1,若净化液中的c(Mg2+)=10-2mol/L,说明Mg2+的存在不会影响MnCO3的纯度,
答:Ksp (MnCO3)=c(Mn2+)•c(CO32-),当Mn2+沉淀完全时,c(CO32-)=$\frac{1.8×1{0}^{-11}}{1.0}$×10-5=1.8×10-6mol•L-1,若Mg2+也能形成沉淀,则要求Mg2+>2.6×10-5/1.8×10-6=14.4 mol•L-1,Mg2+的浓度0.01mol/L远小于14.4 mol•L-1,若净化液中的c(Mg2+)=10-2mol/L,说明Mg2+的存在不会影响MnCO3的纯度.
点评 本题考查混合物分离提纯的综合应用,题目难度中等,把握流程分析及混合物分离方法、发生的反应为解答的关键,试题侧重分析与实验能力的考查,有利于提高学生的分析能力和化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 黄曲霉素、亚硝胺及3,4-苯并芘是世界公认的三大强烈致癌物质,3,4-苯并芘是一种稠环芳烃,其结构简式如图所示,则一氯3,4-苯并芘有( )
黄曲霉素、亚硝胺及3,4-苯并芘是世界公认的三大强烈致癌物质,3,4-苯并芘是一种稠环芳烃,其结构简式如图所示,则一氯3,4-苯并芘有( )| A. | 8种 | B. | 10种 | C. | 12种 | D. | 20种 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
 已知前四周期六种元素A、B、C、D、E、F的核电荷数依次增大.B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成AC型离子化合物,其中的阴、阳离子相差一个电子层.E4+离子和氩原子的核外电子排布相同,F元素含量决定了人体内血红蛋白携氧能力的大小.请回答:
已知前四周期六种元素A、B、C、D、E、F的核电荷数依次增大.B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成AC型离子化合物,其中的阴、阳离子相差一个电子层.E4+离子和氩原子的核外电子排布相同,F元素含量决定了人体内血红蛋白携氧能力的大小.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
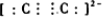 ,其中α键和π键数目之比为1:2.
,其中α键和π键数目之比为1:2.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a(A-N+3)}{A+3}$mol | B. | $\frac{a(A-N+8)}{A+16}$mol | ||
| C. | $\frac{a(2A-2N+40)}{2A+90}$mol | D. | $\frac{2A-2N+24}{2A+54}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
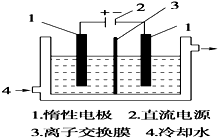 碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2的消耗速率等于NO的消耗速率 | |
| B. | 容器内始终有N2、O2和NO共存 | |
| C. | 容器内反应混合物的总物质的量不随时间改变 | |
| D. | V正(N2)=V逆(N2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com