

分析 第①步加硫酸溶解生成TiO2+和Fe2+、Fe3+等,第②步加铁粉还原Fe3+,过滤除去滤渣,第③步冷却结晶,过滤得到FeSO4•7H2O和含有TiO2+的溶液;第④步加热,热水使TiO2+水解生成H2TiO3,过滤得到H2TiO3;第⑤步H2TiO3受热分解生成化生成TiO2.
(1)铁粉将Fe3+转化为Fe2+;
(2)溶液中析出晶体是利用物质溶解度的不同得到;
(3)②③④都是从溶液中得到固体的分离过程,需要用过滤装置;
(4)依据溶液中存在平衡:TiO2++2H2O?H2TiO3+2H+,平衡影响因素和平衡移动原理分析;
(5)根据流程分析;
(6)①阳极上水失电子生成羟基和氢离子;
②根据电子守恒分析.
解答 解:(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为:2Fe3++Fe=3Fe2+;
故答案为:2Fe3++Fe═3Fe2+;
(2)步骤③冷却结晶得到硫酸亚铁晶体,利用的是物质溶解度的不同,通过冷却热饱和溶液得到;
故答案为:B;
(3))②③④步骤的操作过程中都得到沉淀或晶体,所以需要过滤得到固体和溶液;
故答案为:过滤;
(4)中使用热水的目的是促进TiO2+水解生成H2TiO3,分离出固体加热得到TiO2;溶液中存在平衡:TiO2++2H2O?H2TiO3+2H+,当加入热水稀释、升温后,平衡正向移动,生成H2TiO3;
故答案为:溶液中存在平衡:TiO2++2H2O?H2TiO3+2H+,当加入热水稀释、升温后,平衡正向移动,生成H2TiO3;
(5)从流程可知,最终废液中有硫酸,可循环利用;
故答案为:H2SO4或硫酸;
(6)①阳极上水失电子生成羟基和氢离子,其电极方程式为:H2O-e-=•OH+H+;
故答案为:H2O-e-=•OH+H+;
②1molO2转化为2molH2O2转移2mole-,由Fe2++H2O2=Fe3++OH-+•OH可知,生成2mol•OH,转移2mole-,在阳极上生成2mol•OH,所以消耗1molO2,可以产生4mol•OH;
故答案为:4.
点评 本题考查了物质分离的流程分析判断,物质性质的应用,离子性质的应用,分离操作的方法,氧化还原反应的离子方程式的书写方法,电解池原理的应用,电极反应的书写原则.


科目:高中化学 来源: 题型:选择题

| A. | 双酚A的分子式是C15H16O2 | |
| B. | 双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3 | |
| C. | 反应①中,1 mol双酚A最多消耗6 mol Br2 | |
| D. | 反应②的产物中只有一种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO、H2CO3、HNO3、HClO4的酸性依次增强 | |
| B. | NaCl中混有KNO3,可用蒸发结晶趁热过滤得到NaCl | |
| C. | HCl、NH3、C2H5OH均易溶于水的原因之一是与H2O分子均形成氢键 | |
| D. | 以极性键结合的分子不一定是极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 的说法正确的是( )
的说法正确的是( )| A. | 所有碳原子有可能都在同一平面上 | |
| B. | 最多只可能有9个碳原子在同一平面上 | |
| C. | 有5个碳原子可能在同一直线上 | |
| D. | 至少有6个碳原子在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44g CO2和N2O的混合物中含有的氧原子数为1.5NA | |
| B. | 2L 0.5mol/L亚硫酸氢钠溶液中含有的HSO3-离子数为NA | |
| C. | 0.5mol CH5+中含有的电子数目为5NA | |
| D. | 常温下,1L 0.5 mol/L Ba(OH)2溶液中水电离的OH-个数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用灼烧法可鉴别毛笔羊毫的真伪 | |
| B. | 用墨写字、画画可长久不褪色 | |
| C. | 纸及造纸原料的主要成分均是纤维素 | |
| D. | 砚石中含有一定量的SiO2,SiO2因分子间作用力大,所以硬度大,耐磨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
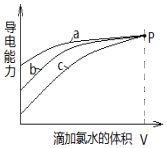
| A. | 曲线a代表H2SO3溶液 | |
| B. | 曲线b代表的溶液中:c(Na+)═c(H2SO3)+c(HSO3-)+c(SO32-)+c(SO42-) | |
| C. | 曲线a、b、c代表的溶液中均始终保持:2c(Cl-)=c(SO42-) | |
| D. | 当滴加氯水体积均为V时,三种溶液的导电能力基本相同,c(H+)也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的氢化物比R的氢化物稳定,沸点高 | |
| B. | 原子半径大小关系为:X>R>Z>Y>W | |
| C. | X与Y形成的两种常见化合物中阴、阳离子的个数比均为l:2 | |
| D. | Z、W、R最高价氧化物对应水化物的酸性由强到弱顺序是:R>W>Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com