



科目:高中化学 来源: 题型:
| A、CO |
| B、CO2 |
| C、CO和 CO2 |
| D、C2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HF═H++F- |
| B、Ba(OH)2═Ba2++2OH- |
| C、H3PO4═3H++PO43- |
| D、NH3?H2O═NH4++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
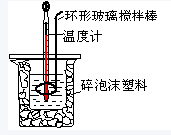
| 起始温度/℃ | 终止温度/℃ | 温度差/℃ | |||
| HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.2 | 24.35 | 27.6 | 3.25 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 过氧乙酸 本品包括甲、乙两种溶液,体积各500mL,把甲、乙溶液各1份在玻璃容器中混合后放置24小时后,其中过氧乙酸浓度不少于10%,应用50倍纯水稀释(浓度为0.2%)稀释后才能使用. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.3 |
| 沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 | 10.8 |
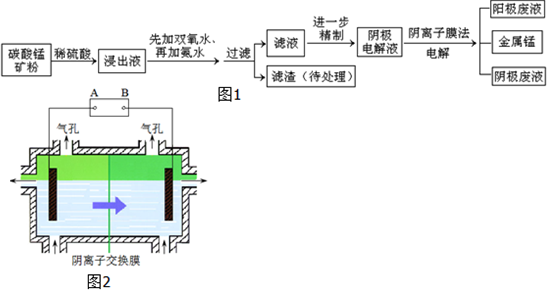
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com