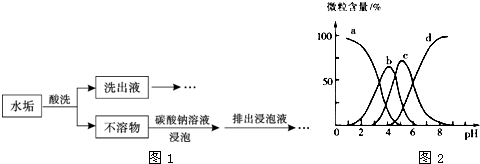
某课外小组同学做了如下探究实验:将蘸有饱和氯化铁溶液的粉笔,用坩埚钳夹持置于酒精灯火焰上灼烧,一分钟内可观察到如下颜色变化:黄色(氯化铁溶液)--红褐色(A)--铁锈红色(B)--黑色(C).
(1)关于粉笔由黄色变红褐色,请你结合化学用语给出简要解释
.
(2)写出(A)→(B)变化的化学方程式
.对于黑色产生的原因,讨论时形成了2种不同的观点,甲组同学认为是粉笔吸收了酒精未完全燃烧产生的碳粒所致,而乙组同学则认为可能是灼烧过程中铁元素价态发生了变化.他们仍只用粉笔和酒精灯解决了上述争议,直接证明了乙组观点的合理性.其实验方案可能是
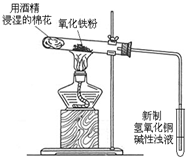
.为进一步确认乙组的结论,他们进行了进一步的探究:如图所示加热氧化铁,观察到红色粉末逐渐变黑.之后,移动酒精灯只微热试管底部,使黑色固体在乙醇气雾中慢慢冷却.停止实验,取下新制的氢氧化铜试管加热,试管中有红色沉淀生成.
(3)写出加热盛有碱性氢氧化铜浊液试管时反应的化学方程式
.对黑色物质的成分,大家进行了分析讨论.之后取出黑色粉末进行如下实验探究:
a.取黑色粉末加入足量稀硫酸,微热,全部溶解,未观察到任何气泡产生;
b.取a步骤所得溶液少量,加入到酸性 KMnO
4溶液中,观察到紫色褪去;
c.另取a步骤所得溶液少量,加入硫氰化钾溶液,出现血红色.
(4)实验a说明黑色粉末中不含有
;
(5)根据上述实验结果判断,黑色粉末的化学成分可能是
;为进一步确认黑色粉末的成分,下列实验方案可行的是(选填序号)
;
A.准确称量一定质量的黑色粉末,用 H
2 充分还原,并用干燥剂收集所得水,获得水的准确质量,进行计算.
B.准确称量一定质量的黑色粉末,溶解于足量盐酸,加热蒸干溶液并在空气中灼烧至质量不变,称量所得粉末质量,进行计算.
C.准确称量一定质量的黑色粉末,溶解于足量盐酸,配成一定体积的溶液,设法测定其中 Fe
3+ 浓度,进行计算.
D.准确称量一定质量的黑色粉末,用 CO 充分还原,在CO气流中冷却后准确称量剩余固体的质量,计算.
E.准确称量一定质量的黑色粉末,与一定质量铝粉混合后点燃,充分反应后冷却,准确称量剩余固体质量,进行计算.
(6)假设铁的氧化物用Fe
aO
b表示,请你写出上述酒精还原氧化铁反应的化学方程式
.



 某课外小组同学做了如下探究实验:将蘸有饱和氯化铁溶液的粉笔,用坩埚钳夹持置于酒精灯火焰上灼烧,一分钟内可观察到如下颜色变化:黄色(氯化铁溶液)--红褐色(A)--铁锈红色(B)--黑色(C).
某课外小组同学做了如下探究实验:将蘸有饱和氯化铁溶液的粉笔,用坩埚钳夹持置于酒精灯火焰上灼烧,一分钟内可观察到如下颜色变化:黄色(氯化铁溶液)--红褐色(A)--铁锈红色(B)--黑色(C).