
 将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )
将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )| A、整个过程中阳极先产生Cl2,后产生O2 |
| B、阳极极产物一定是Cl2,阴极产物一定是Cu |
| C、BC段表示在阴极上是H+放电产生了H2 |
| D、CD段表示阳极上OH一放电破坏了水的电离平衡,产生了H+ |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| B、氯气溶于水:Cl2+H2O?2H++Cl-+ClO- |
| C、硫酸溶液中加入铁粉:2Fe+6H+=2Fe3++3H2O |
| D、碳酸氢钠溶液中加入氢氧化钠溶液:HCO3-+OH-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CH4分子的球棍模型: | ||
B、Cl-离子的结构示意图: | ||
C、氟化钠的电子式: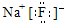 | ||
D、中子数为146、质子数为92 的铀原子
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%.
全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 0.1032mol/L HCI体积体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 25.00 |
| 2 | 26.53 | 25.00 |
| 3 | 27.85 | 25.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在世界上我国首先合成了具有生命活力的蛋白质--结晶牛胰岛素 |
| B、蛋白质是组成细胞的基础物质,它是小分子物质 |
| C、蛋白质水解的最终产物是氨基酸 |
| D、高温灭菌的原理是加热后使蛋白质变性,从而使细菌死亡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com