
 .
.分析 A元素的原子核内只有1个质子,则A为H元素;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3,则B的最高化合价为+5价,位于周期表第ⅤA族,应为N元素;C元素原子的最外层电子数比次外层多4个,则C原子只能有2个电子层,最外层电子数为6,则C应为O元素;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C,则D的化合价为+1价,其原子序数大于O元素,则D为a元素;C、E主族,则E为S元素,据此进行解答.
解答 解:A元素的原子核内只有1个质子,则A为H元素;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3,则B的最高化合价为+5价,位于周期表第ⅤA族,应为N元素;C元素原子的最外层电子数比次外层多4个,则C原子只能有2个电子层,最外层电子数为6,则C应为O元素;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C,则D的化合价为+1价,其原子序数大于O元素,则D为a元素;C、E主族,则E为S元素,
(1)B为N元素,原子核外有2个电子层,最外层电子数为5,则位于周期表第二周期ⅤA族,
故答案为:第二周期ⅤA族;
(2)E为S元素,最高价氧化物的水化物为H2SO4,铜与浓硫酸反应的离子方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑;
(3)S2-离子核外有3个电子层,比O2-、Na+离子多1个电子层,故离子半径最大,O2-与Na+离子核外电子排布相同,都有2个电子层,核电核数越大,半径越小,则半径O2->Na+,故离子半径大小为:S2->O2->Na+,
故答案为:S2-;O2-;Na+;
(4)化合物D2C为Na2O,为离子化合物,用电子式表示的形成过程为 ,
,
故答案为: ;
;
(5)A、C分别为H、O元素,二者形成的既有极性键又有非极性键的共价化合物为双氧水,双氧水的结构式为:H-O-O-H,
故答案为:H-O-O-H.
点评 本题考查元素位置结构性质的相互关系应用,题目难度中等,正确推断元素为解答该题的关键,注意熟练掌握原子结构与元素周期表、元素周期律的关系,试题培养了学生的分析、理解能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
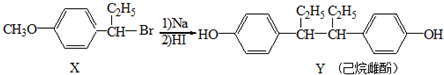
| A. | 在NaOH水溶液中加热,化合物X可发生消去反应 | |
| B. | 在一定条件,化合物Y不能与HCHO发生缩聚反应 | |
| C. | 用FeCl3溶液可鉴别化合物X和Y | |
| D. | 1mol化合物Y可消耗3mol溴水发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ④③ | C. | ⑤③ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
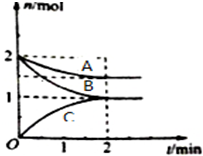 一定温度下,某容积为2L的密闭容器内,某一反应中A、B、C三种气体的物质的量随反应时间变化的曲线如图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中A、B、C三种气体的物质的量随反应时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
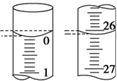 氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,按要求完成下列问题:
氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,按要求完成下列问题:| 滴定次数 | 待测H2C2O4溶液的体积/mL | 0.1000mol•L-1 KMnO4的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol葡萄糖在酒化酶作用下水解生成2mol乙醇和2mol二氧化碳 | |
| B. | 在一定条件下CO和氢气作用得到液体燃料的过程是煤的液化途径之一 | |
| C. | 石油的重整可以提高汽油的质量和芳烃的产量 | |
| D. | 往蛋白质溶液中加入饱和硫酸钠溶液,产生的沉淀再加水又可溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH(OH)CH3 | B. | CH3CH2OCH3 | C. | CH3CH2CH2OH | D. | CH3CH2CHO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com