
科目:高中化学 来源: 题型:选择题
| A. | 3.0g甲醛和甲酸甲酯的混合物中含有的原子数为0.4NA | |
| B. | 常温下,1L0.1mol•L-1CuSO4溶液中粒子总数小于0.2NA | |
| C. | 1 mol冰醋酸和1 mol乙醇在浓硫酸加热下充分反应生成H2O个数为NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
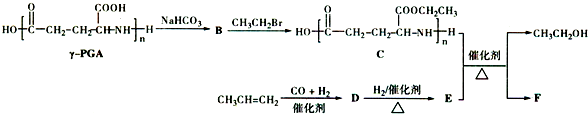
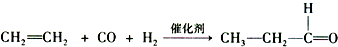
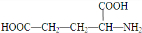 .
.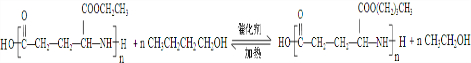 .
.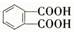 )反应生成的产物DBP(C16H22O4)是广泛使用的增塑剂之一.DBP有多种同分异构体,其中符合下列条件的DBP的同分异构体有12种,写出其中一种同分异构体的结构简式
)反应生成的产物DBP(C16H22O4)是广泛使用的增塑剂之一.DBP有多种同分异构体,其中符合下列条件的DBP的同分异构体有12种,写出其中一种同分异构体的结构简式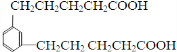 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验装置 | 现象 |
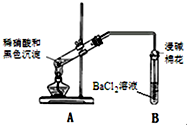 | 1.A试管中黑色沉淀逐渐溶解 2.A试管内上方出现红棕色气体 3.B试管中出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
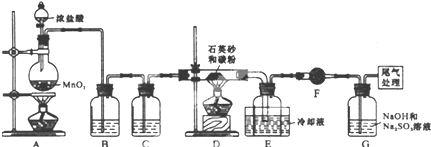
| 序号 | 操作 | 可能出现的现象 | 结论 |
| ① | 向a试管中滴加几滴0.01mol/L的KMnO4(或溴水)溶液 | 若溶液褪色 | 则假设1成立 |
| 若溶液不褪色 | 则假设2或3成立 | ||
| ② | 向b试管中滴加几滴品红溶液 | 若溶液褪色 | 则假设1或3成立 |
| 若溶液不褪色 | 假设2成立 | ||
| ③ | 向C试管中滴加几滴淀粉-KI溶液 | 若溶液变为蓝色 | 假设3成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
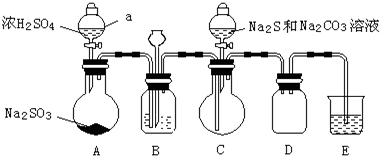
| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: Na2S、Na2CO3 Na2SO4 及 Na2SO3 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2CO3, 一定不含有Na2S、Na2SO4. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol的CaO2含阴阳离子总数是0.3NA | |
| B. | 0.1 mol苯乙烯含π键的数目为0.4NA | |
| C. | 1 L 1mol/L的Na2CO3溶液中含阴阳离子数小于3NA | |
| D. | 2.3 g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
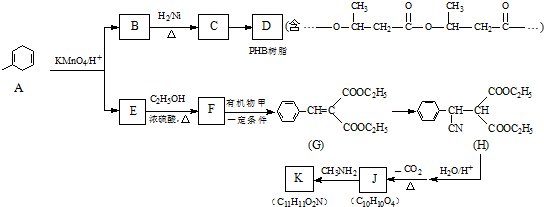
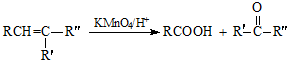
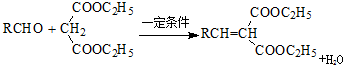
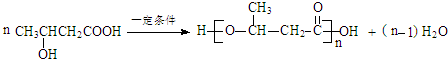 :.
:. .
.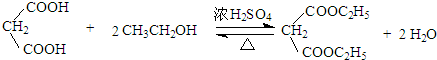 .
.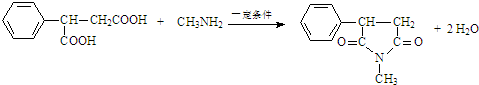 .
.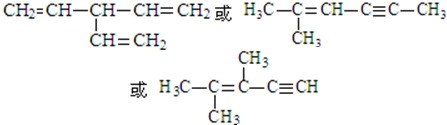 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
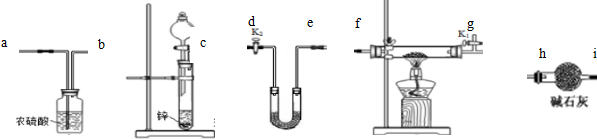
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com