
下列说法正确的是
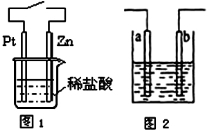
A.与铜质水龙头连接处的钢质水管不易发生腐蚀
B.用电解法提取氯化铜废液中的铜,可以用碳棒连接电源的正极,另一电极用铜片
C.图1中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图2所示装置可发生反应的离子方程式为Zn + 2H+=Zn2++ H2↑,且a、b电极不可能是同种材料
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:
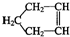 可简写为
可简写为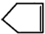 .降冰片烯的分子结构可表示为:
.降冰片烯的分子结构可表示为: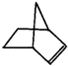
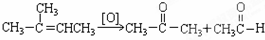
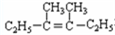 在上述类似条件下发生反应,请写出反应的方程式
在上述类似条件下发生反应,请写出反应的方程式查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高三第一次月考理综化学试卷(解析版) 题型:选择题
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+=2Fe3++2H2O、2Fe3++H2O2=2Fe2++O2↑+2H+,下列说法不正确的是
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+强
B.在H2O2分解过程中, Fe2+和Fe3+的总量保持不变
C.在H2O2分解过程中,溶液的pH逐渐下降
D.H2O2生产过程要严格避免混入Fe2+
查看答案和解析>>
科目:高中化学 来源:2015届广东省海珠等四区高三联考理综化学试卷(解析版) 题型:填空题
(16分)合成喹啉及其衍生物常用的方法是Skraup合成法,以下是用苯胺、甘油、浓硫酸和硝基苯共热制备喹啉的反应流程。
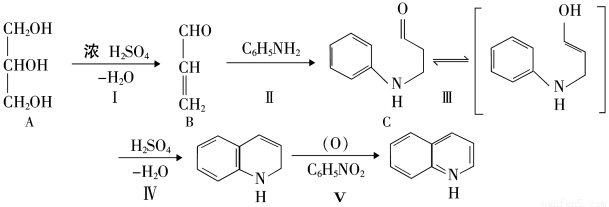
(1)上图中A的名称为 ,C的分子式为
(2)II的反应类型为
(3)下列关于化合物C的说法,正确的是
A.1mol化合物C最多能与3mol氢气反应
B.可发生银镜反应
C.能使酸性高锰酸钾溶液褪色
D.属于芳香烃
(4)①化合物E和F也能发生类似II的反应,请写出生成物的结构简式。
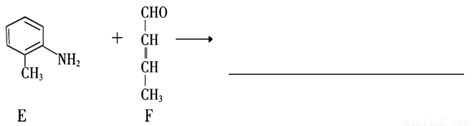
②化合物F有多种同分异构体,其中属于醛类的有(不包括该物质本身) (写结构简式)
查看答案和解析>>
科目:高中化学 来源:2015届广东省揭阳市高三上学期第一次阶段考试理综试卷(解析版) 题型:填空题
(16分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
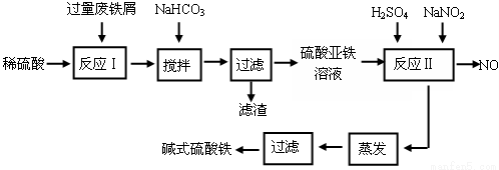
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在 范围内,使溶液中的 沉淀(写离子符号)。
(2)反应Ⅱ中加入NaNO2的目的是 ,发生反应的离子方程式为 。
(3)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为 。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为 。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源:2015届广东省揭阳市高三上学期第一次阶段考试理综试卷(解析版) 题型:选择题
下列关于金属及其化合物的叙述正确的是
A.Fe与S混合加热生成FeS2
B.过量的Cu与浓硝酸会有NO生成
C.NaHCO3、Na2CO3、MgCO3受热均能分解生成气体
D.Na2O2与水反应、红热的Fe与水蒸气反应均能反应生成碱
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三9月第二次月考化学试卷(解析版) 题型:填空题
(16分)废旧锂离子电池的正极材料(主要含有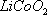 及少量Al、Fe等)可用于回收钴、锂,实验方法如下:
及少量Al、Fe等)可用于回收钴、锂,实验方法如下:
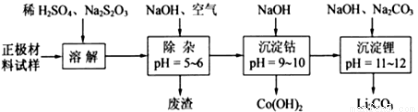
已知:Fe3+开始沉淀pH=2.7, 完全沉淀pH=3.2; Al3+开始沉淀pH=3.8, 完全沉淀pH=5.2; Co2+完全沉淀pH=9.15
(1)在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中反应的化学方程式为 ,氧化剂是_________________________________。
(2)在上述除杂过程中,通入空气的作用是_____________________。通入空气和加入NaOH溶液后发生的离子方程式是______________ 废渣的主要成分是Al (OH)3和_______________。
(3)“沉淀钴”和“沉淀锂”的离子方程式分别为_________________、_________________。
(4)该工艺可回收的副产品是_________________________(写化学式)。
查看答案和解析>>
科目:高中化学 来源:2015届广东省佛山市高三10月月考化学试卷(解析版) 题型:选择题
下列各组物质的无色溶液,不用其它试剂即可鉴别的是
A.NaHCO3 Na2CO3 BaCl2
B.KOH Na2SO4 AlCl3
C.KHCO3 NaHSO4
D.Ca(OH)2 Na2SO3 BaCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com