
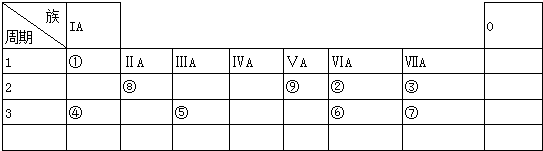

分析 根据元素在周期表中的位置,可知①为H、②为O、③为F、④为Na、⑤为Al、⑥为S、⑦为Cl、⑧为Be、⑨为N.
(1)周期表中元素最高正价与最低价代数和为零的元素位于IVA;
(2)同周期自左而右元素非金属性增强,非金属性越强,最高价含氧酸的酸性越强;
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物为H2O2,在酸性溶液中能将Fe2+氧化Fe3+,同时生成水;
(4)两性氢氧化物和强碱反应生成盐和水;
(5)已知W+X=Y+Z,W、X、Y、Z分别是由①②⑨三种元素形成的四种十电子粒子,应该为铵根离子与氢氧根离子的反应,据此书写反应式;
(6)由表中元素形成的物质,其中B、C、G是单质,B为黄绿色气体,则B为Cl2,D溶液显碱性,电解A溶液为电解氯化钠溶液生成氢气、氯气与氢氧化钠,故D为NaOH、C为H2,则E为HCl,G能与氢氧化钠溶液反应得到得到氢气与F,故G为Al,F为NaAlO2.
解答 解:根据元素在周期表中的位置,可知①为H、②为O、③为F、④为Na、⑤为Al、⑥为S、⑦为Cl、⑧为Be、⑨为N.
(1)周期表中元素最高正价与最低价代数和为零的元素位于IVA,故答案为:IVA;
(2)非金属性Cl>S,非金属性越强,最高价含氧酸的酸性越强,故酸性:HClO4>H2SO4,故答案为:HClO4>H2SO4;
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物为H2O2,在酸性溶液中能将Fe2+氧化Fe3+,同时生成水,反应离子方程式为:H2O2+2Fe2++2H+=2Fe3++2H2O,故答案为:H2O2+2Fe2++2H+=2Fe3++2H2O;
(4)两性氢氧化物和强碱反应生成盐和水,反应的化学方程式为Be(OH)2+2NaOH=Na2BeO2+2H2O,故答案为:Be(OH)2+2NaOH=Na2BeO2+2H2O;
(5)已知W+X=Y+Z,W、X、Y、Z分别是由①②⑨三种元素形成的四种十电子粒子,应该为铵根离子与氢氧根离子的反应,该反应式为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
(6)由表中元素形成的物质,其中B、C、G是单质,B为黄绿色气体,则B为Cl2,D溶液显碱性,电解A溶液为电解氯化钠溶液生成氢气、氯气与氢氧化钠,故D为NaOH、C为H2,则E为HCl,G能与氢氧化钠溶液反应得到得到氢气与F,故G为Al,F为NaAlO2,则:
①D溶液与G反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
②检验NaCl溶液中溶质的阴离子的方法:取少量A溶液滴加几滴稀硝酸酸化的硝酸银溶液有白色沉淀生成,
故答案为:取少量A溶液滴加几滴稀硝酸酸化的硝酸银溶液有白色沉淀生成.
点评 本题考查元素周期表与元素周期律、无机物的推断,为高考常见题型,侧重于学生的分析能力的考查,难度中等,(6)中关键是根据离子放电顺序理解电解原理判断A物质,注意混合物X与E、F的量有关,需要学生具备扎实的基础.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
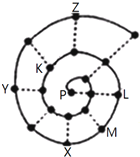 如图所示为“蜗牛”状的元素周期表,其中每个“•”代表一种元素,P点代表氢元素.下列说法正确的是( )
如图所示为“蜗牛”状的元素周期表,其中每个“•”代表一种元素,P点代表氢元素.下列说法正确的是( )| A. | Y元素对应的氢化物比Z元素对应的氢化物更稳定 | |
| B. | 虚线相连的元素处于同一族 | |
| C. | M、K元素的离子半径大小顺序是M2+>K2- | |
| D. | 由K、L两种元素组成的化合物中不可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分液漏斗分液时,先打开旋塞,待下层液体完全分出后,关闭旋塞,再从上口倒出上层液体 | |
| B. | 在油脂皂化反应实验中,用玻璃棒蘸取反应液滴入热水中,若无油滴浮于液面上,说明皂化反应已经完全 | |
| C. | 在中和热测定实验中,盐酸和NaOH溶液的总质量m g,反应前后体系温度变化△t℃,反应液的比热容为c J•g-1•℃-1,则生成1mol水放出的热量为cm△t×10-3kJ | |
| D. | 同一温度下,可通过观察出现浑浊的快慢来探究浓度对Na2S2O3与稀硫酸反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数是2 | B. | 质量数是1 | C. | 电子数是3 | D. | 中子数是2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com