
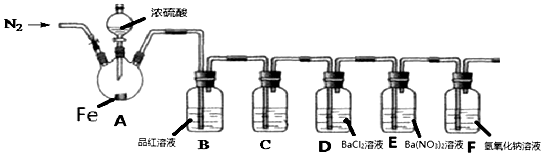
·ÖĪö ŹµŃéæŖŹ¼Ē°£¬ĻČ“ņæŖµÆ»É¼ŠĶØŅ»¶ĪŹ±¼äN2£¬ĻČÅųö×°ÖĆÖŠµÄæÕĘų£¬AÖŠµĪ¼ÓŅ»¶ØĮæµÄÅØĮņĖį£¬¹Ū²ģŹµŃéĻÖĻó£¬Č»ŗó¼ÓČČ£¬Č”³öAÖŠµÄČÜŅŗÉŁŠķ£¬¼ÓČėKSCNČÜŅŗĪ“³öĻÖŃŖŗģÉ«£¬æÉÖŖAÖŠ·¢ÉśFe+2H2SO4£ØÅØ£©$\frac{\underline{\;\;”÷\;\;}}{\;}$FeSO4+SO2”ü+2H2O£¬BÖŠĘ·ŗģæɼģŃ鶞Ńõ»ÆĮņµÄÉś³É£¬C×°ÖƵÄ×÷ÓĆŹĒ³żČ„¶žŃõ»ÆĮņĘųĢåÖŠĮņĖįÕōĘū£¬µ«²»ÄܳżČ„¶žŃõ»ÆĮņ£¬DÖŠ¶žŃõ»ÆĮņÓėĀČ»Æ±µ²»·“Ó¦£¬EÖŠ·¢ÉśŃõ»Æ»¹Ō·“Ӧɜ³ÉĮņĖį±µ³Įµķ£¬FĪŖĪ²Ęų“¦ĄķĪüŹÕ¹żĮæµÄ¶žŃõ»ÆĮņ£¬ŅŌ“ĖĄ“½ā“š£®
½ā“š ½ā£ŗ£Ø1£©ĢśĘ¬ÉĻµĪČėÅØĮņĖįĪ“¼ÓČČĒ°Ć»ÓŠĆ÷ĻŌĻÖĻóµÄŌŅņŹĒĢś±ķĆęÉś³ÉÖĀĆÜŃõ»ÆĤ»ņĢś·¢Éś¶Ū»Æ£¬
¹Ź“š°øĪŖ£ŗĢś±ķĆęÉś³ÉÖĀĆÜŃõ»ÆĤ»ņĢś·¢Éś¶Ū»Æ£»
£Ø2£©ÓÉÉĻŹö·ÖĪöæÉÖŖ£¬AÖŠ·“Ó¦µÄ»Æѧ·½³ĢŹ½Fe+2H2SO4£ØÅØ£©$\frac{\underline{\;\;”÷\;\;}}{\;}$FeSO4+SO2”ü+2H2O£¬
¹Ź“š°øĪŖ£ŗFe+2H2SO4£ØÅØ£©$\frac{\underline{\;\;”÷\;\;}}{\;}$FeSO4+SO2”ü+2H2O£»
£Ø3£©A”¢B”¢C¾łÓė¶žŃõ»ÆĮņ·“Ó¦£¬Ö»ÓŠD³żČ„ĮņĖįĒŅ²»³żČ„¶žŃõ»ÆĮņ£¬
¹Ź“š°øĪŖ£ŗD£»
£Ø4£©ŹµŃéæŖŹ¼Ē°£¬ĻČĶØŅ»¶ĪŹ±¼äN2µÄÄæµÄŹĒ³żČ„×°ÖĆÄŚµÄæÕĘų£Ø»ņŃõĘų£©£¬·ĄÖ¹¶žŃõ»ÆĮņ±»Ńõ»Æ£¬
¹Ź“š°øĪŖ£ŗ³żČ„×°ÖĆÄŚµÄæÕĘų£Ø»ņŃõĘų£©£¬·ĄÖ¹¶žŃõ»ÆĮņ±»Ńõ»Æ£»
£Ø5£©æÉŅŌÖ¤Ć÷H2SO3ŹĒČõĖįµÄŹµŃé×°ÖĆŹĒD£¬DÖŠĪŽĻÖĻó£¬æÉÖŖŃĪĖįµÄĖįŠŌ“óÓŚŃĒĮņĖįµÄĖįŠŌ£¬
¹Ź“š°øĪŖ£ŗD£»
£Ø6£©EÖŠµÄ°×É«³ĮµķŹĒBaSO4£¬øĆ³ĮµķµÄÉś³É±ķĆ÷SO2¾ßÓŠ»¹ŌŠŌ£¬¹Ź“š°øĪŖ£ŗBaSO4£» »¹Ō£»
£Ø7£©×°ÖĆFµÄ×÷ÓĆŹĒĪ²Ęų“¦Ąķ£¬·ĄÖ¹ĪŪČ¾æÕĘų£¬øĆ×°ÖĆÖŠ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ2NaOH+SO2=Na2SO3+H2O£¬¹Ź“š°øĪŖ£ŗĪ²Ęų“¦Ąķ£¬·ĄÖ¹ĪŪČ¾æÕĘų£»2NaOH+SO2=Na2SO3+H2O£®
µćĘĄ ±¾Ģāæ¼²éŠŌÖŹŹµŃé·½°øµÄÉč¼Ę£¬ĪŖøßĘµæ¼µć£¬°ŃĪÕŹµŃé×°ÖƵÄ×÷ÓĆ”¢ŌŖĖŲ»ÆŗĻĪļÖŖŹ¶”¢ŹµŃé¼¼ÄÜĪŖ½ā“šµÄ¹Ų¼ü£¬²ąÖŲ·ÖĪöÓėŹµŃéÄÜĮ¦µÄ漲飬עŅāŌŖĖŲ»ÆŗĻĪļÖŖŹ¶ÓėŹµŃéµÄ½įŗĻ£¬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
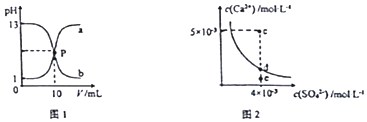
| A£® | Ķ¼1ÖŠPµćČÜŅŗ£ŗc£ØNa+ £©=c£ØCl-£©£¾c£ØH+ £©=c£ØOH- £© | |
| B£® | ÓÉĶ¼1æÉÖŖŃĪĖįŗĶNaOHČÜŅŗµÄÅØ¶Č¾łĪŖ1mol•L-1 | |
| C£® | Ķ¼2ÖŠcµćÓŠ³ĮµķÉś³É£¬“ļĘ½ŗāŗóČÜŅŗÖŠc£ØSO42- £©=3”Į10-3 mol•L-1 | |
| D£® | æÉĶعżÕō·¢½«Ķ¼ 2ÖŠeµćµÄČÜŅŗ±äµ½dµć |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŠæĆĢøɵē³Ų¹¤×÷Ņ»¶ĪŹ±¼äŗóĢ¼°ō±äĻø | |
| B£® | ŌŚŗ£ĀÖĶāæĒÉĻĻāČėŠææéæɼõ»ŗ“¬ĢåµÄøÆŹ“£¬ŹĒ²ÉÓĆĮĖĪžÉüŃō¼«µÄŅõ¼«±£»¤·Ø | |
| C£® | ĶŠæŌµē³Ų¹¤×÷Ź±£¬µē×ÓŃŲĶāµēĀ·“ÓĶµē¼«Į÷ĻņŠæµē¼« | |
| D£® | µē½āMgCl2±„ŗĶČÜŅŗ£¬æÉÖĘµĆ½šŹōĆ¾ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | ·“Ó¦¢ŚÖŠ·“Ó¦ĪļĖł¾ßÓŠµÄ×ÜÄÜĮæ“óÓŚÉś³ÉĪļĖł¾ßÓŠµÄ×ÜÄÜĮæ | |
| B£® | 2N2H4£Øg£©+2NO2£Øg£©=3N2£Øg£©+4H2O£Øl£©”÷H=-1135.7 kJ/mol | |
| C£® | ²¬×÷µē¼«£¬KOHČÜŅŗ×÷µē½āÖŹČÜŅŗ£¬ÓÉ·“Ó¦¢ŚÉč¼ĘµÄČ¼ĮĻµē³Ų£¬µ±µēĀ·ÖŠ×ŖŅĘ0.16mole-£¬Éś³ÉN211.2g | |
| D£® | ²¬×÷µē¼«£¬Na2SO4×÷µē½āÖŹČÜŅŗ£¬ÓÉ·“Ó¦¢ŚÉč¼ĘµÄČ¼ĮĻµē³Ų£¬¹¤×÷Ņ»¶ĪŹ±¼äŗó»Öø“ÖĮŌĪĀ¶Č£¬Na2SO4ČÜŅŗµÄpH²»±ä |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | SO2£Øg£©+NaOH£Øaq£©ØTNaHSO3£Øaq£©”÷H=-£Ø2a-b£©kJ/mol | |
| B£® | SO2£Øg£©+NaOH£Øaq£©ØTNaHSO3£Øaq£©”÷H=-£Ø4b-a£©kJ/mol | |
| C£® | SO2£Øg£©+NaOH£Øaq£©ØTNaHSO3£Øaq£©”÷H=-£Øa-4b£©kJ/mol | |
| D£® | SO2£Øg£©+NaOH£Øaq£©ØTNaHSO3£Øaq£©”÷H=-£Ø4a-b£©kJ/mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
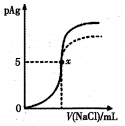 ŅŃÖŖ£ŗpAg=-lg[c£ØAg+£©]£®Ksp£ØAgCl£©=1”Įl0-10£¬Ksp£ØAgI£©=l”Įl0-17£®ČēĶ¼ŹĒĻņl0mLAgNO3ČÜŅŗÖŠ¼ÓČė0£®lmol/LNaCIČÜŅŗŹ±£¬ČÜŅŗµÄpAgĖę׿ÓČėNaClČÜŅŗµÄĢå»ż±ä»ÆµÄĶ¼Ļó£ØŹµĻߣ©£®øł¾ŻĶ¼ĻóĖłµĆĻĀĮŠ½įĀŪÕżČ·µÄŹĒ£Ø””””£©
ŅŃÖŖ£ŗpAg=-lg[c£ØAg+£©]£®Ksp£ØAgCl£©=1”Įl0-10£¬Ksp£ØAgI£©=l”Įl0-17£®ČēĶ¼ŹĒĻņl0mLAgNO3ČÜŅŗÖŠ¼ÓČė0£®lmol/LNaCIČÜŅŗŹ±£¬ČÜŅŗµÄpAgĖę׿ÓČėNaClČÜŅŗµÄĢå»ż±ä»ÆµÄĶ¼Ļó£ØŹµĻߣ©£®øł¾ŻĶ¼ĻóĖłµĆĻĀĮŠ½įĀŪÕżČ·µÄŹĒ£Ø””””£©| A£® | ŌAgNO3ČÜŅŗµÄĪļÖŹµÄĮæÅضČĪŖ0£®l mol/L | |
| B£® | Ķ¼ÖŠxµć±ķŹ¾ČÜŅŗÖŠc£ØAg+£©=c£ØCl-£© | |
| C£® | Ķ¼ÖŠxµćµÄ×ų±źĪŖ£Ø10£¬5£© | |
| D£® | °ŃNaClČÜŅŗ»»³É0.1 mol/LµÄMaClČÜŅŗ£¬ŌņĶ¼ĻóŌŚÖÕµćŗó±äĪŖŠéĻß²æ·Ö |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
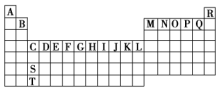
| A£® | Ō×Ó°ė¾¶£ŗA£¼B£¼C | |
| B£® | ČżÖÖŌŖĖŲµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļ¾łæÉÓÉ»ÆŗĻ·“Ó¦µĆµ½ | |
| C£® | AµÄĒā»ÆĪļĪČ¶ØŠŌŠ”ÓŚCµÄĒā»ÆĪļĪČ¶ØŠŌ | |
| D£® | B ŗĶAµÄ×īøß¼ŪŃõ»ÆĪļæÉ·¢ÉśÖĆ»»·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com