
【题目】以溴乙烷为原料制备乙二醇,下列方案中最合理的是
A. CH3CH2Br![]() CH2=CH2
CH2=CH2![]() CH2BrCH2Br
CH2BrCH2Br![]() 乙二醇
乙二醇
B. CH3CH2Br![]() CH2BrCH2Br
CH2BrCH2Br![]() 乙二醇
乙二醇
C. CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH2BrCH2OH
CH2BrCH2OH![]() 乙二醇
乙二醇
D. CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH2=CH2
CH2=CH2![]() CH2BrCH2Br
CH2BrCH2Br![]() 乙二醇
乙二醇
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】根据地球化学分析,地壳中存在量较大的9种元素含量如图所示(含量最高的四种元素用字母代号表示)。下列说法正确的是( )

A. X为硅元素,M为铁元素
B. 地壳中有游离态的Y元素和M元素
C. Z和M的氧化物均属于碱性氧化物
D. Z的单质通过置换反应可制取M的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应的离子方程式书写正确的是
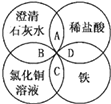
A. OH+HCl=H2O+ClB. Ca(OH)2+Cu2+=Ca2++Cu(OH)2
C. Fe+Cu2+=Cu+Fe2+D. Fe+2H+=Fe3++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下对反应的化学方程式,并注明反应类型:
(1)乙醇制乙烯:_________________,反应类型:_________________。
(2)乙醇与浓氢溴酸反应:_________________,反应类型_________________。
(3)苯酚与浓溴水反应:_________________,反应类型_________________。
(4)乙醛与银氨溶液反应:_________________,反应类型_________________。
(5)乙醛与新制氢氧化铜悬浊液反应:_________________,反应类型_________________。
(6)乙酸乙酯与氢氧化钠溶液反应:_________________,反应类型_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物其结构简式为![]() ,关于该有机物下列叙述正确的是
,关于该有机物下列叙述正确的是
A. 在加热和催化剂作用下,1mol该有机物最多能和4mol H2反应
B. 不能使溴的CCl4溶液褪色
C. 不能使酸性KMnO4溶液褪色
D. 一定条件下,能和NaOH醇溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的产物中,存在同分异构体的是( )
A. CH3CH2CH2Br在碱性溶液中水解
B. 甲苯在催化剂作用下与Cl2发生苯环上的取代反应
C. ![]() 与NaOH的醇溶液共热反应
与NaOH的醇溶液共热反应
D. ![]() 在催化剂存在下与H2完全加成
在催化剂存在下与H2完全加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应A2(g)+2B2(g)===2AB2(g)(AB2的分子结构为B—A—B)的能量变化如图所示,下列有关叙述中正确的是:
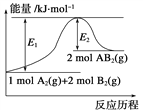
A. 该反应的进行一定需要加热
B. 该反应的ΔH=-(E1-E2) kJ·mol-1
C. 断裂1 mol A—A键和2 mol B—B键,放出E1 kJ能量
D. 该反应中,反应物的键能总和大于生成物的键能总和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒奶粉事件曾一度震惊全国,主要是奶粉中含有有毒的三聚氰胺。下列关于三聚氰胺分子的说法中正确的是( )
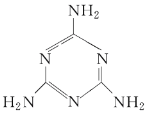
A. 所有氮原子均采取sp3杂化
B. 一个三聚氰胺分子中共含有15个σ键
C. 三聚氰胺的分子式为C3N3H6
D. 三聚氰胺分子中同时含有极性键和非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰是一种重要的化工中间体,是锰行业研究的热点。一种以高硫锰矿(主要成分为含锰化合物及FeS)为原料制备硫酸锰的工艺流程如下:
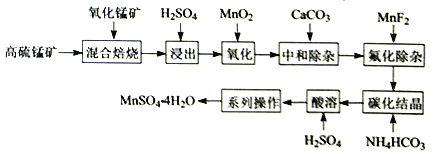
已知:
①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO。
②金属离子在水溶液中的平衡浓度与pH的关系如图所示(25℃):
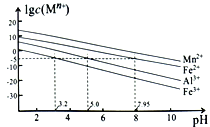
③此实验条件下Mn2+开始沉淀的pH为7.54;离子浓度≤10-5mol·L-1时,离子沉淀完全。
请回答:
(1)传统工艺处理高硫锰矿时,不经“混合焙烧”,而是直接用H2SO4浸出,其缺点为________。
(2)“氧化”时,发生反应的离子方程式为_________________________。若省略“氧化”步骤,造成的后果是_________________________。
(3)“中和除杂”时,生成沉淀的主要成分为______________________(填化学式)。
(4)“氟化除杂”时,若使溶液中的Mg2+和Ca2+沉淀完全,需维持c(F-)不低于___________。(已知:Ksp(MgF2)=6.4×10-10;Ksp(CaF2)=3.6×10-12)
(5)“系列操作”指___________、过滤、洗涤、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com