
【题目】相对分子质量为86的饱和链烃A含有四个甲基,A在光照下与氯气反应,只得到三种一氯取代产物B、C和D。B和D分别与强碱的醇溶液共热,都只能得到有机物E。以上反应及B的进一步反应如下图所示。请按要求填空。
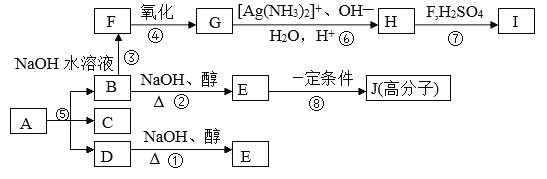
(1)A的分子式为__________,A的名称为_____________________________。
(2)写出下列物质的结构简式:C_________________;G__________________。
(3)写出下列反应的化学方程式并指出所属的有机反应类型:
反应①______,反应类型为________。反应⑦_________,反应类型为_________。
【答案】 C6H14 2,2-二甲基丁烷  (CH3)CCH2CHO (CH3)3CCHClCH3+NaOH
(CH3)CCH2CHO (CH3)3CCHClCH3+NaOH![]() (CH3)3CCH=CH2+NaCl+H2O 消去反应 (CH3)3CCH2COOH+(CH3)3CCH2CH2OH
(CH3)3CCH=CH2+NaCl+H2O 消去反应 (CH3)3CCH2COOH+(CH3)3CCH2CH2OH![]() (CH3)3CCH2COOCH2CH2C(CH3)3+H2O 取代反应(酯化反应)
(CH3)3CCH2COOCH2CH2C(CH3)3+H2O 取代反应(酯化反应)
【解析】本题考查有机推断和合成。(1)根据烷烃的通式CnH2n+2,可知相对分子质量为86的饱和链烃的分子为为C6H14,A含有四个甲基,故A的结构简式为(CH3)3CCH2CH3或(CH3)2CHCH(CH3)2,由A在光照下与氯气反应,只得到三种一氯取代产物B、C和D,推出A为(CH3)3CCH2CH3,名称2,2-二甲基丁烷;(2)A的一氯代物B和D分别与强碱的醇溶液共热,都只能得到有机物E,故B和D 可能为(CH3)3CCHClCH3或(CH3)3CCH2CH2Cl,C的结构简式为: ,再根据B与NaOH的水溶液反应生成F,F氧化得到G,G能与银氨溶液反应生成H,可逆推H为酸,含有羧基,G中含有醛基,F为伯醇(含—CH2OH结构),B为(CH3)3CCH2CH2Cl,即F为(CH3)3CCH2CH2OH、G为(CH3)3CCH2CHO,H为(CH3)3CCH2COOH;(3)根据(2)可知,D为(CH3)3CCHClCH3,D在加热的条件下与NaOH的醇溶液发生消去反应,其①的反应方程式为:(CH3)3CCHClCH3+NaOH
,再根据B与NaOH的水溶液反应生成F,F氧化得到G,G能与银氨溶液反应生成H,可逆推H为酸,含有羧基,G中含有醛基,F为伯醇(含—CH2OH结构),B为(CH3)3CCH2CH2Cl,即F为(CH3)3CCH2CH2OH、G为(CH3)3CCH2CHO,H为(CH3)3CCH2COOH;(3)根据(2)可知,D为(CH3)3CCHClCH3,D在加热的条件下与NaOH的醇溶液发生消去反应,其①的反应方程式为:(CH3)3CCHClCH3+NaOH![]() (CH3)3CCH=CH2+NaCl+H2O;H在硫酸的作用下,与F发生酯化反应,其反应⑦的反应方程式为:(CH3)3CCH2COOH+(CH3)3CCH2CH2OH
(CH3)3CCH=CH2+NaCl+H2O;H在硫酸的作用下,与F发生酯化反应,其反应⑦的反应方程式为:(CH3)3CCH2COOH+(CH3)3CCH2CH2OH![]() (CH3)3CCH2COOCH2CH2C(CH3)3+H2O。
(CH3)3CCH2COOCH2CH2C(CH3)3+H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】室温下向10 mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( )
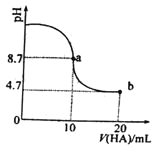
A. a 点所示溶液中 c(Na+)>c(A-)>c(H+)>c(HA)
B. a、b 两点所示溶液中水的电离程度相问
C. b点所示溶液中c(A-)>c(HA)
D. pH=7时,c(Na+)=c(A-)+c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol/L NaOH溶液滴定 20.00mL 0.1000 mol/L
CH3COOH溶液滴定曲线如右图。下列说法正确的是
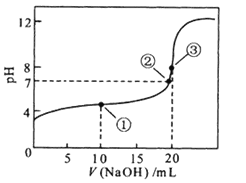
A. 点①所示溶液中:c(CH3COO-)+ c(OH-) =c(CH3COOH)+ c(H+)
B. 点②所示溶液中:c(Na+) =c(CH3COOH)+ c(CH3COO-)
C. 点③所示溶液中:c(Na+)> c(OH-)> c(CH3COO-)> c(H+)
D. 滴定过程中可能出现:c(CH3COOH)> c(CH3COO-)> c(H+)> c(Na+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应 3Fe(s)+4H2O(g) ![]() Fe3O4(s)+4H2(g),在一体积可调的密闭容器中进行,采取下列措施对其反应速率几乎无影响的是( )
Fe3O4(s)+4H2(g),在一体积可调的密闭容器中进行,采取下列措施对其反应速率几乎无影响的是( )
A.增加H2的量
B.将容器体积缩小一半
C.保持容器内体积不变,充入Ar使体系压强增大
D.充入Ar,保持容器内压强不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有V、W、X、Y、Z五种元素,它们的原子序数依次增大,且都小于20;其中X和Z是金属元素。已知V和Z属同一族,它们原子最外电子层上只有1个电子,W和Y也属同一族,W原子最外电子层上电子数是次外电子层上电子数的3倍,X原子最外电子层上电子数等于Y原子最外电子层上电子数的一半。请用相关的元素符号回答:
(1)X、Z各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为_____________;
(2)X最高价氧化物对应的水化物在水中电离方程式为:____________________________________;
(3)W与Z 可形成化合物Z2W2,该化合物的电子式为 ______________________________________;
(4)Y与Z形成的化合物水溶液pH ______ 7(填“>”、“<”或“=”),用离子方程式表示其原因 ____________________________________________________________;
(5)标准状况下,Y的最高价氧化物为无色晶体,该条件下0.20 mol该物质与一定量液态水混合得到一种稀溶液,并放出Q kJ的热量。写出该反应的热化学方程式:________________________________;
(6)W与V 可形成化合物V2W2,该化合物的结构式为 ______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知同温同压下,下列反应的焓变和平衡常数分别表示为
①2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=-197kJ/mol K1=a
2SO3(g) ΔH1=-197kJ/mol K1=a
②2NO(g)+O2(g)![]() 2NO2(g) ΔH2=-144kJ/mol K2=b
2NO2(g) ΔH2=-144kJ/mol K2=b
③NO2(g)+SO2(g)![]() SO3(g)+NO(g) ΔH3=mkJ/mol K3=c
SO3(g)+NO(g) ΔH3=mkJ/mol K3=c
下列说法正确的是( )
A. m=-26.5 2c=a-b B. m=-53 c2=a/b
C. m=-26.5 c2=a/b D. m=-53 2c=a-b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷是人体含量较多的元素之一,磷的化合物在药物生产和农药制造等方面用途非常广泛。回答下列问题:
(1)基态磷原子的核外电子排布式为____________________。
(2)P4S3可用于制造火柴,其分子结构如图甲所示。
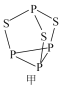
①第一电离能:磷_____________硫;电负性:磷_____________硫(填“>”或“<”)。
②P4S3分子中硫原子的杂化轨道类型为_____________。
③每个P4S3分子中含孤电子对的数目为______________。
(3)N、P、As、Sb均是第VA族的元素。
①上述元素的氢化物的佛点关系如图乙所示,沸点:PH3<NH3,其原因是____________;沸点:PH3<AsH3<SbH3,其原因是______________________________________。
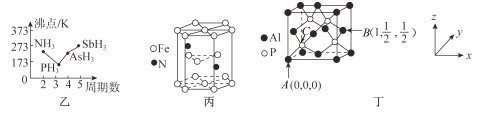
②某种磁性氮化铁的晶胞结构如图丙所示,该化合物的化学式为______。
(4)磷化铝熔点为2000℃,它与晶体硅互为等电子体,磷化铝晶胞结构如图丁所示。
①磷化铝晶体中磷与铝微粒间的作用力为_____________________。
②图中A点和B点的原子坐标参数如图丁所示,则C点的原子坐标参数为________。
③磷化铝晶体的密度为ρg·cm-3,用NA表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个铝原子之间的距离为___________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高聚物的结构如图所示,下列说法正确的是( )
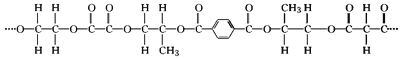
A. 该高聚物为加聚产物
B. 该高分子为体型高分子
C. 该高分子的单体有6种
D. 该高分子中含有酯基、羟基、羧基
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com