
| A. | 54g H218O中含有电子总数为30NA个 | |
| B. | 11.2L H2中含有的电子数为NA个 | |
| C. | 23gNa+含有的最外层电子数为NA个 | |
| D. | 16g氧气和16g臭氧含有的核外电子总数均为8NA |
分析 A、H218O的摩尔质量为20g/mol;
B、氢气所处的状态不明确;
C、求出钠离子的物质的量,然后根据钠离子的最外层有8个电子来分析;
D、氧气和臭氧均由氧原子构成,而氧原子的核外有8个电子.
解答 解:A、H218O的摩尔质量为20g/mol,故54gH218O的物质的量为2.7mol,故含27NA个电子,故A错误;
B、氢气所处的状态不明确,故其物质的量无法计算,故B错误;
C、23g钠离子的物质的量为1mol,而钠离子的最外层有8个电子,故1mol钠离子的最外层有8mol电子即8NA个,故C错误;
D、氧气和臭氧均由氧原子构成,故16g氧气和16g臭氧中含有的氧原子的物质的量均为1mol,而氧原子的核外有8个电子,故1mol氧原子的核外共8NA个电子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
 四种元素中只有一种是金属,下列说法错误的是( )
四种元素中只有一种是金属,下列说法错误的是( )| A. | 气态氢化物稳定性:R>Q | |
| B. | 元素T的离子结构示意图为 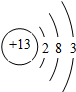 | |
| C. | 与W同主族的某元素形成的18电子的氢化物分子中既有极性键又有非极性键 | |
| D. | Q的一种同位素可用于测定文物的年代 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
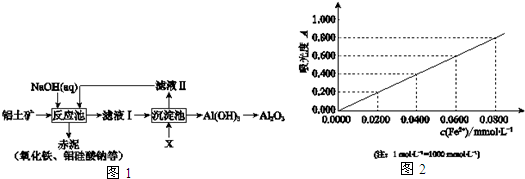
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ③② | C. | ④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚有一定毒性,不能用作消毒剂和防腐剂 | |
| B. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| C. | 乙醇和乙酸都是常用调味品的主要成分 | |
| D. | 可将工业酒精兑水后饮用,因为其中含有甲醇、乙醇,它具有醇香味 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | e | f | h | |||||
| 3 | a | c | d | g | i | j | r | |
| 4 | b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液中加入铁粉:Fe3++Fe=2Fe2+ | |
| B. | 将NH3通入H2SO4溶液中:NH3+H+=NH4+ | |
| C. | FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- | |
| D. | H2SO4溶液与Ba(OH)2溶液混合:H++OH-=H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com