
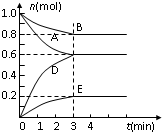
 T℃、2L密闭容器中某一反应不同时刻各物质的量如图(E为固体,其余为气体).回答下列问题:
T℃、2L密闭容器中某一反应不同时刻各物质的量如图(E为固体,其余为气体).回答下列问题:| 物质 | A | B | D | E |
| 物质的量mol | 0.8 | 1.0 | 0.4 | 0.2 |
| △c |
| △t |
 3D+E,故答案为:2A+B
3D+E,故答案为:2A+B 3D+E;
3D+E;| △c |
| △t |
| ||
| 3min |
| c3(D) |
| c2(A)?c(B) |
(
| ||||
(
|
| 3 |
| 4 |
| 3 |
| 4 |
 3D(g)+E(s)前后气体体积不变,所以体积压缩为原来一半时,平衡不移动,D的体积分数不变,所以D的体积分数为:
3D(g)+E(s)前后气体体积不变,所以体积压缩为原来一半时,平衡不移动,D的体积分数不变,所以D的体积分数为:| 0.6 |
| 0.6+0.6+0.8 |
(
| ||||
(
|
| 1 |
| 4 |
| 3 |
| 4 |


科目:高中化学 来源: 题型:
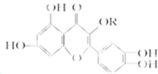 天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( )
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( )| A、可以和溴水反应 |
| B、可用有机溶剂萃取 |
| C、1mol 维生素P可以和7mol H2反应 |
| D、1mol 维生素P可以和4mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、M与A均能使酸性高锰酸钾溶液和溴水褪色 |
| B、B中含有羧基和羟基两种官能团,能发生消去反应和酯化反应 |
| C、A、B、C各1mol分别与金属钠反应,放出气体的物质的量之比为1:2:2 |
| D、1molM与热的烧碱溶液反应,可消耗2nmolNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com