
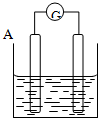
 按要求回答下列问题:
按要求回答下列问题:分析 (1)电流表的指针由正极偏向负极,偏向B极,则B为负极,A为正极;
(2)原电池中负极的活泼性大于正极的活泼性,负极上金属失电子变成离子进入溶液,质量减少,正极上得电子发生还原反应,正极上析出物质,若析出的物质是金属,则正极质量增加;
(3)若电解质溶液是稀硫酸,按此图组装后,观察到A极不断的溶解,B极有气泡冒出,溶解的一极为负极,产生气泡的为正极,负极活泼;
(4)若该电池中发生的反应为:Fe+2FeCl3═3FeCl2,A电极为铁,A为负极,则B电极选择比A不活泼的金属或非金属导体.
解答 解:(1)电流表的指针由正极偏向负极,偏向B极,则B为负极,A为正极,故答案为:正;负;
(2)该原电池中,A极逐渐增加,B极逐渐减少,所以B作负极,A作正极,B的活泼性大于A的活泼性,所以排除AC选项;
A极逐渐增加,说明有金属析出,B选项析出氢气不是金属,D选项析出金属,所以D符合题意.
故选D;
(3)若电解质溶液是稀硫酸,按此图组装后,观察到A极不断的溶解,B极有气泡冒出,溶解的一极为负极,产生气泡的为正极,负极活泼,故答案为:A>B;
(4)若该电池中发生的反应为:Fe+2FeCl3═3FeCl2,A电极为铁,A为负极,则B电极选择比A不活泼的金属或非金属导体,故A电极为铜或碳棒,故答案为:铜或碳棒.
点评 本题考查原电池知识,侧重于学生的分析能力的考查,注意把握原电池的工作原理,学习中注意相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水、浓硫酸 | B. | KMnO4酸性溶液、浓硫酸 | ||
| C. | 溴水、浓硫酸 | D. | 浓硫酸、KMnO4酸性溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电电池可以通过放电、充电实现化学能和电能的相互转化 | |
| B. | 放电时负极发生氧化反应,充电时该电极上有物质发生得电子的反应 | |
| C. | 现代技术使得电池设计比较先进,电池废弃后不必再进行无毒化处理 | |
| D. | 充电电池的化学反应原理是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:丁>丙>乙>甲 | |
| B. | 1mol A与足量B完全反应共转移了2mol电子 | |
| C. | 丙元素在周期表中的位置为第二周期第ⅣA族 | |
| D. | 甲、乙、丙、丁四种元素可以共同组成多种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com