
己知:①CH3OH(g) +3/2O2(g)=CO2(g)+2H2O(g) △H=-a kJ·mol-l
②CH4(g) +2O2 (g) =CO2 (g) +2H2O(g) △H=-b kJ·mol-l
⑧CH4(g) +2O2 (g) =CO2 (g) +2H2O(1) △H=-c kJ·mol-l
则下列叙述正确的是
A.由上述热化学方程式可知b>c
B.甲烷的燃烧热为bkJ/mol
C.2CH3OH (g) =2CH4(g)+O2(g) △H=2(b-a) kJ·mol-l
D.当甲醇和甲烷物质的量之比为1:2时,其完全燃烧生成CO2和H2O (1)时,放出的热量为Q kJ,则该混合物中甲醇的物质的量为Q/(a+2b) mol
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年河北省高二上开学测化学试卷(解析版) 题型:选择题
要除去CO2中含有的少量的SO2杂质,可选用的一组试剂是( )
①NaOH溶液 ②NaHCO3溶液 ③Na2CO3溶液 ④HNO3酸化的Ba(NO3)2溶液 ⑤氨水 ⑥酸性KMnO4溶液
A.②⑥ B.②③ C.②④⑥ D.②③⑥
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上开学测化学试卷(解析版) 题型:实验题
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
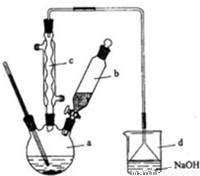
| 苯 | 溴 | 溴苯 |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按以下合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑。在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白雾产生,是因为生成了_________气体,继续滴加至液溴滴完。装置d的作用是_________;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是_________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是_________;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为_________,要进一步提纯,下列操作中必须的是____________(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是_____________(填入正确选项前的字母):
A.25mL B.50mL C.250mL D.500mL
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上开学测化学试卷(解析版) 题型:选择题
乙烯和乙醇的混合气体V L,完全燃烧后生成CO2和H2O,消耗相同状态下的氧气3VL。则混合气体中乙烯和乙醇的体积比( )
A.2 : 1 B.1 : 1 C.1:2 D.任意比
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上第二次月考化学试卷(解析版) 题型:实验题
重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3)为原料生产重铬酸钾。实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图所示。反应器中涉及的主要反应是:6 FeO·Cr2O3 + 24NaOH + 7KClO3 = 12Na2CrO4 + 3Fe2O3 + 7KCl + 12H2O

试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应的原理相同均转变为可溶性盐。写出氧化铝与碳酸钠反应的化学方程式:______________________。
(2)操作⑤中加酸酸化后CrO42-转化为Cr2O72-,写出转化的离子方程式:_________________。
(3)步骤③中测定pH值的操作为:________________。
(4)某同学设计的检验上述工艺流程④的滤渣中Fe、Al、Si元素成分的探究实验如下,请帮助完成该实验,并填写表中空格:
操作步骤 | 实验现象 | 结论 |
①取滤渣样少量于试管中,加足量稀HCl,搅拌,静置。 | 试管中仍有固体物质 | 固体为_____________ |
②操作①后,过滤;在滤液中加入过量的____________。 | 有红褐色沉淀产生 | 沉淀为Fe (OH)3 |
③将操作②后的红褐色沉淀滤去,在滤液中通入足量CO2。 | _____________ | 生成物为Al (OH)3; |
(5)称取重铬酸钾(其式量为294)试样2.5000 9配成250 mL溶液,用移液管取出25. 00 mL于碘量瓶中,加入10 mL 2 mol/L H2SO4和足量碘化钾(铬的还原产物为Cr3+),放置于暗处5 min,然后加入100 mL水,加入3 mL淀粉指示剂,用0.1200 mol/L Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①配制溶液时所需的玻璃仪器除烧杯、玻璃棒外,还需________和________________。
②若实验中共用去Na2S2O3标准溶液40. 00 mL,则所得产品中重铬酸钾的纯度为(设整个过程中其他杂质不参与反应)____________。(保留2位小数)
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三第一次摸底化学试卷(解析版) 题型:填空题
[化学—选修2:化学与技术]
海水占地球总储水量的97.2﹪。若把海水淡化和化工生产结合起来,既能解决淡水资源缺乏的问题,又能充分利用海洋资源。
下图是利用海水资源进行化工生产的部分工艺流程示意图:

(1)该工艺流程示意图中包含了 、 (填化学工业的名称)。
(2)在流程Ⅰ中,欲除去粗盐中含有的Ca2+、Mg2+、SO42+等离子,需将粗盐溶解后,按顺序加入药品进行沉淀、过滤等。加入药品和操作的顺序可以是 (填字母)。
A.Na2CO3、NaOH、 BaCl2、过滤、盐酸
B.NaOH、 BaCl2、 Na2CO3、过滤、盐酸
C.NaOH、 Na2CO3、 BaCl2、过滤、盐酸
D.BaCl2、Na2CO3、 NaOH、 过滤、盐酸
(3)流程Ⅱ中,通电开始后,阳极区产生的气体是 (填化学式),阴极附近溶液pH会 (填“增大”、“减小”或“不变”)。
(4)流程Ⅲ中,通过相应化学反应可以得到NaHCO3晶体。下图为NaCl、NH4Cl、NaHCO3、NH4HCO3的溶解度曲线,其中能表示NaHCO3溶解度曲线的是 ,生成NaHCO3晶体的化学反应方程式是 。

(5)流程Ⅳ中,所得纯碱常含有少量可溶性杂质,常用的提纯方法是 (填名称),通过该法提纯后得到纯净的Na2CO3·10H2O,Na2CO3·10H2O脱水得到无水碳酸钠。
已知:Na2CO3·H2O(s)=Na2CO3(s)+H2O(g) ΔH1=+58.73kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH2=+473.63 kJ·mol-1
把脱水过程产生的气态水完全液化释放的热能全部用于生产Na2CO3所需的能耗(不考虑能量损失),若生产1molNa2CO3需要耗能92.36kJ,由此得出:H2O(g)= H2O(l) △H= 。
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三第一次摸底化学试卷(解析版) 题型:选择题
聚甲基丙烯酸酯( )的缩写代号为PMMA,俗称有机玻璃。下列说法中错误的是
)的缩写代号为PMMA,俗称有机玻璃。下列说法中错误的是
A.聚甲基丙烯酸甲酯属于有机干分子合成材料
B.聚甲基丙烯酸甲酯的分子式可表示为(C5H8O2)n
C.合成PMMA的单体是甲基丙烯酸和甲醇
D.甲基丙烯酸甲酯[CH2=C(CH3)COOCH3]中碳原子可能都处于同一平面
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期摸底考试化学试卷(解析版) 题型:选择题
已知放热反应:2Na+2NH3(l)=2NaNH2+H2↑,下列说法正确的是
A.常温常压下,2.24LNH3中含有共价键0.3mol
B.该反应过程中,每生成1mol NaNH2,转移电子2mol
C.在该反应条件下,Na的还原性强于H2
D.该反应过程中熵减,所以高温条件下能自发进行
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上学期摸底化学试卷(解析版) 题型:选择题
在现行元素周期表中,所含元素种类最多的族和周期分别是( )
A. 第ⅠA族 第六周期 B. 第Ⅷ族 第六周期
C. 第ⅢB族 第六周期 D. 第ⅢA族 第六周期
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com