
��֪A(g)+B(g)  C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
| �¶�/�� | 700 | 900 | 830 | 1000 | 1200 |
| ƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
 A(g)+B(g)��ƽ�ⳣ����ֵΪ___________________��
A(g)+B(g)��ƽ�ⳣ����ֵΪ___________________�� 2P��g��+Q��s����Ӧ�����±�����Ͷ�ϣ���Ӧ�ﵽƽ��״̬�������ϵѹǿ���ߣ������÷�Ӧ��ƽ�ⳣ�����¶ȵı仯��ϵ��__________________________________________________________________________________��
2P��g��+Q��s����Ӧ�����±�����Ͷ�ϣ���Ӧ�ﵽƽ��״̬�������ϵѹǿ���ߣ������÷�Ӧ��ƽ�ⳣ�����¶ȵı仯��ϵ��__________________________________________________________________________________��| �� �� | M | N | P | Q |
| ��ʼͶ��/mol | 2 | 1 | 2 | 0 |
�����8�֣���1��0.022 mol��L-1 0.09mol ���� ��3�֣� ��2��c ��2�֣�
��3��2.5 ��1�֣� ��4���÷�Ӧ��ƽ�ⳣ�����¶ȵ����߶���С��2�֣�
���������������1��6s��A��ƽ����Ӧ����v��A����0.003mol?L-1?s-1�����c��A����0.003mol?L-1?s-1��6s��0.018mol?L-1����6sʱA��Ũ��Ϊ0.2mol��5L��0.018mol/L��0.022mol/L����n��A����0.018mol?L-1��5L��0.09mol���ɷ���ʽ��֪��n��C������n��A����0.09mol
��������ʽ����ƽ��ʱ����ֵ����ʵ�������
A��g��+B��g�� C��g��+D��g��
C��g��+D��g��
��ʼ����mol�� 0.2 0.8 0 0
ת������mol�� 0.09 0.09 0.09 0.09
6sʱ��mol�� 0.11 0.71 0.09 0.09
���ڷ�Ӧǰ��������䣬����Ũ����Qc��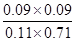 ��1
��1
���Է�Ӧ������Ӧ���У�������Ӧ���ʴ����淴Ӧ����
��2����һ�������£������淴Ӧ������Ӧ���ʺ��淴Ӧ�������ʱ������Ϊ0������Ӧ��ϵ�и������ʵ�Ũ�Ȼ������ٷ����仯��״̬����Ϊ��ѧƽ��״̬��a���÷�Ӧǰ����������ʵ������䣬ѹǿʼ�ղ��䣬��ѹǿ����ʱ��ı䣬����˵������ƽ�⣬��a����b���÷�Ӧǰ�������������䣬���������������䣬������ܶ�ʼ�ղ��䣬��b����c�����淴Ӧ����ƽ��ʱ�������ʵ�Ũ�Ȳ��䣬��c��A������ʱ��ı䣬˵������ƽ�⣬��c��ȷ��d����λʱ��������C��D�����ʵ�����ȣ�����ʾ����Ӧ���ʣ���Ӧʼ�հ�1:1���ɣ�����˵������ƽ�⣬��d����ѡc��
��3��ͬһ�¶��£�ͬһ��Ӧ�������淴Ӧ��ƽ�ⳣ����Ϊ��������1200��ʱ��ӦC��g��+D��g�� A��g��+B��g����ƽ�ⳣ����ֵΪ
A��g��+B��g����ƽ�ⳣ����ֵΪ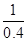 ��2.5��
��2.5��
��4������ʼQ�����ʵ���Ϊ0��֪����Ӧ������Ӧ���н���ƽ�⣬����Ӧ�����������С�ķ�Ӧ��������������䣬ƽ��ʱѹǿ���ʾ��������£����������¶����ߣ�������ӦΪ���ȷ�Ӧ�������¶�ƽ�����淴Ӧ���У���ѧƽ�ⳣ����С�����÷�Ӧ��ƽ�ⳣ�����¶ȵı仯��ϵ�÷�Ӧ��ƽ�ⳣ�����¶ȵ����߶���С��
���㣺���鷴Ӧ���ʡ�ƽ�ⳣ���ļ��㣻���������ƽ��״̬��Ӱ���


 �����Ƹ���ʦ����ϵ�д�
�����Ƹ���ʦ����ϵ�д� ��ͨ����ͬ����ϰ��ϵ�д�
��ͨ����ͬ����ϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
һ���¶��µ��ܱ������д������·�Ӧ��
CO(g)+H2O(g) CO2(g)+ H2(g)����֪CO(g)��H2O(g)����ʼŨ�Ⱦ�Ϊ2 mol��L-1�����ⶨ�÷�Ӧ�ڸ��¶��µ�ƽ�ⳣ��K =1�����жϣ�
CO2(g)+ H2(g)����֪CO(g)��H2O(g)����ʼŨ�Ⱦ�Ϊ2 mol��L-1�����ⶨ�÷�Ӧ�ڸ��¶��µ�ƽ�ⳣ��K =1�����жϣ�
(1)��COת����Ϊ25%ʱ���÷�Ӧ�Ƿ�ﵽƽ��_______����δ�ﵽƽ�⣬���ĸ��������______��
(2)�ﵽƽ��ʱ��CO��ת����____________________��
(3)��CO����ʼŨ����Ϊ2 mol��L-1��H2O(g)����ʼŨ��Ϊ6 mol��L-1����ƽ��ʱCO��ת����_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�о�NOx�����������SO2��CO�ȴ�����Ⱦ����IJ���������������Ҫ���塣
��1����ͼ�� ��Ӧ����������ʾ��ͼ��
��Ӧ����������ʾ��ͼ��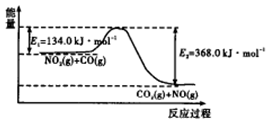
�÷�Ӧ���ʱ�
��2��һ�������£�ͨ��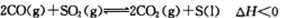 ����ʵ��ȼú��������Ļ��ա�ij�о�С����2Lij�ܱյ������������������������䣬��������������Բ��ƣ���ͨ��CO��SO2��10���Ӻ�������CO2�����ʵ���Ϊ0.9mol��
����ʵ��ȼú��������Ļ��ա�ij�о�С����2Lij�ܱյ������������������������䣬��������������Բ��ƣ���ͨ��CO��SO2��10���Ӻ�������CO2�����ʵ���Ϊ0.9mol��
������v(CO2)��ʾ�ķ�Ӧ����Ϊ ��
�ڸ÷�Ӧ��ƽ�ⳣ���ı���ʽΪ��K= ��
������ӿ�����Ӧ���ʵ�ͬʱ���SO2��ת���ʣ����Բ��õķ����� ��
��3����ҵ�ϳ���Na2CO3��Һ���շ����������������NO��NO2�Ļ����Ϊ������
��֪��NO������Na2CO3��Һ��Ӧ��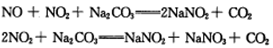
����������Na2CO3��Һ��ȫ����NO��NO2�Ļ���ÿ����22.4L����״����CO2��ȫ���ݳ���ʱ������Һ����������44g������������NO��NO2�������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ѧѧ���е�ƽ��������Ҫ��������ѧƽ�⡢����ƽ�⡢ˮ��ƽ����ܽ�ƽ�����֣��Ҿ�������������ԭ������ش��������⣺
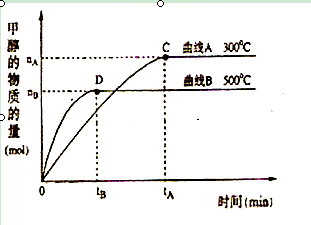
��1�������£�ȡ pH=2������ʹ�����Һ��100mL, �����зֱ����������Zn������Ӧ����������Һ��pH�仯��ͼ��ʾ����ͼ�б�ʾ������Һ��pH�仯���ߵ��� ( �A����B��)�� �������м����Zn����Ϊm1��������Һ�м����Zn����Ϊ m2�� �� m1 m2 ( ѡ�<������=������>��)
��2�������Ϊ3L���ܱ������У�CO��H2��һ�������·�Ӧ���ɼ״���CO ( g) + 2H2( g) �� CH3OH(g) ����Ӧ�ﵽƽ��ʱ��ƽ�ⳣ������ʽK= �������¶ȣ�Kֵ (���������С�����䡱)����500�棬�ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v(H2)=
��3�������£�ij������Һ�е����̪����Һ�ʺ�ɫ��˵������Һ�� �ԡ��ڷ�������Һ����̪�ʺ�ɫԭ��ʱ����ͬѧ��Ϊ��������Һ���õĴ�����Ʒ�л���NaOH ���£���ͬѧ��Ϊ����Һ��Na2CO3�������CO32-ˮ�����¡��������һ����ʵ�鷽����������λͬѧ��˵��������(��������������ͽ���) ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(12��)��ҵ������ʱ�����ýӴ�������Ӧ��SO2ת��ΪSO3��һ���ؼ��IJ��衣
(1)�ڽӴ�����2SO2(g)+O2(g)  2SO3(g)�ﵽƽ��״̬�ı�־��______��
2SO3(g)�ﵽƽ��״̬�ı�־��______��
| A����(O2)��=2��(SO2)�� |
| B�����������������������ʱ����仯 |
| C���������������ɫ����ʱ����仯 |
| D�������������ѹǿ����ʱ����仯 |
 2SO3(g) ��H<0������ͼ���в���ȷ����______ (����ĸ��ţ���
2SO3(g) ��H<0������ͼ���в���ȷ����______ (����ĸ��ţ���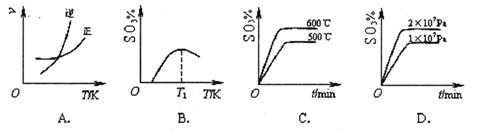
 O2(g)
O2(g)  SO3(g) ��H=-98KJ/mol
SO3(g) ��H=-98KJ/mol�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
һ���¶��£���1.0L�ܱ������м���0.60molX(g)��������ӦX(g)  Y(s)+2Z(g)��H��0��÷�Ӧ��XŨ���뷴Ӧʱ����������±�
Y(s)+2Z(g)��H��0��÷�Ӧ��XŨ���뷴Ӧʱ����������±�
| ��Ӧʱ��t/min | 0 | 1 | 2 | 3 | 4 | 6 | 8 |
| c(X)/(mol��L-1) | 0.60 | 0.42 | 0.30 | 0.21 | 0.15 | a | 0.0375 |
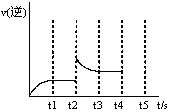
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
2012�궬�����ҹ����п�����Ⱦ״���ܵ����ǵ�ǿ�ҹ�ע������NOx��CO��SO2����Ҫ��Ⱦ�����塣
I��������ȼ������ʱ�����ķ�Ӧ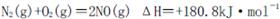 �ǵ�������β ���к���NO����Ҫԭ��֮һ��
�ǵ�������β ���к���NO����Ҫԭ��֮һ��
��1��������ѡ�ú��ʵĴ�����ʹ��Ӧ2NO��g��=N2��g��+O2��g���ܽϿ�����Դﵽ��ȥNO��Ŀ�ġ�����Ϊ�÷�Ӧ�ܷ��Է����� ����ܡ����ܡ�����
��2�����ô������ɽ�����β���е�NO����ת���������壬��ط�Ӧ��ƽ�ⳣ���ɱ�ʾΪ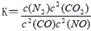 ���˷�ӦΪ���ȷ�Ӧ����һ���¶��£�10Lij�ܱ������з���������Ӧ�������ʵ����ʵ����ı仯������±�
���˷�ӦΪ���ȷ�Ӧ����һ���¶��£�10Lij�ܱ������з���������Ӧ�������ʵ����ʵ����ı仯������±�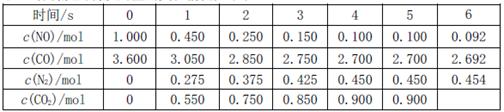
�ٸ����������ݼ���0~4s����NO��ʾ��ƽ������v��NO��= ���ﵽ��ѧƽ��ʱ���ַ�Ӧ���ת�����Ƿ���� �����ȡ�����ȡ�����
����5~6sʱ����K����5s������Ӧ���� �������С����
����5~6sʱ����K���䣬���ϸ����ʵ����ʵ����仯ԭ������� ��
A��ѡ�ø���Ч�Ĵ��� B����С���������
C������CO2Ũ�� D�������¶�
IIΪ̽������������ȼ�յIJ������Ƿ���SO3��ij��ѧ��ȤС���ھ��Ȼ����½����˶���ʵ��̽����̽��ʵ��������������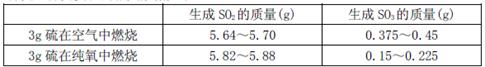
��3�������ݽ��з�����֪�������������ڴ�����ȼ�ղ�����SO3���ڿ�����ȼ�ղ�����SO3 ����ࡱ���١�����ԭ������� ��
A������������Ũ�ȸߣ������ڻ�ѧƽ��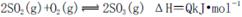 �����ƶ�
�����ƶ�
B����ѧ��Ӧ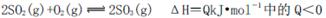
C������������Ũ�ȸߣ���λʱ���ڷ���������ʹ��Ӧ��ϵ���¶Ƚϸߣ������ڻ�ѧƽ��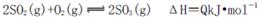 �����ƶ�
�����ƶ�
D��3g���ڴ�����ȼ�ձ�3g���ڿ�����ȼ�շų��������࣬�����ڻ�ѧƽ��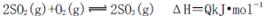 �����ƶ�
�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��һ�̶��ݻ�Ϊ2 L���ܱ������м���2 molA��3 molB�������¶�Ϊ30�棬��
�������ڵ������½������з�Ӧ��2A(g)+3B(g)  3C(g)��2���Ӵﵽƽ�⣬����1.5 mol
3C(g)��2���Ӵﵽƽ�⣬����1.5 mol
C����ʱ��ƽ��������C���������Ϊ��1�������¶����ߵ�70����������������䣬��
��Ӧ���´ﵽƽ��ʱ��C�����ʵ���Ϊ2.1 mol���������Ϊ��2����ش��������⣬
��1���÷�Ӧ��30��ʱƽ�ⳣ��K1= ���ʱ��H 0(�>������<����=��)��
��2���÷�Ӧ��30��ʱƽ��������C���������Ϊ��1= ���ӷ�Ӧ��ʼ���ﵽ��ѧƽ��״̬ʱv(A)��____________mol/(L��min)
��3���÷�Ӧ��70��ʱƽ�ⳣ��ΪK2���� K1 K2(�����������������)
��4��70��ʱ���������¶Ȳ��䣬��2 L���ܱ������м���4 molA��6 molB������Ӧ���´ﵽƽ��ʱ��C���������Ϊ��3�����3 ��2 (�>������<����="��" )��
��5�������ж�2A(g)+3B(g)  3C(g) ��Ӧ�Ѿ��ﵽƽ�����(����)
3C(g) ��Ӧ�Ѿ��ﵽƽ�����(����)
A��2v(B)��3v(A)
B���ܱ���������ѹǿ����
C���ܱ������л��������ܶȲ���
D����������ƽ����Է����������ٸı�
E��n(A)��n(B)��n(C)��2��3��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
�������ڹ�ҵ�������й㷺����;��
��1��SO2�����ڹ�ҵ����SO3��
����һ�������£�ÿ����8g SO3���壬����9.83kJ���÷�Ӧ���Ȼ�ѧ����ʽΪ________��
����500�棬�������ڵ������£����ݻ�Ϊ1L�ļס��������ܱ������о����� 2 mol SO2��1 mol O2���ױ���ѹǿ���䣬�ұ����ݻ����䣬��ַ�Ӧ����ﵽƽ�⡣
I��ƽ��ʱ����������SO3��������Ĺ�ϵΪ����_______�ң��>������<���� =������
II��������t1 minʱ�ﵽƽ�⣬��ʱ�����������SO2��ת����Ϊ90%�����
��Ӧ��ƽ�ⳣ��Ϊ_______�������¶Ȳ��䣬t2 minʱ����������г���1 mol SO2��1 mol SO3��t3minʱ�ﵽ��ƽ�⡣������ͼ�л���t2~t4 min�����淴Ӧ���ʵı仯���ߣ������ϱ������V����V�� ��
��2������þ���壨MgSO4��7H2O )���Ƹҽҩ��������й㷺��;��4.92g����þ����������ˮ���̵��������ߣ������������¶ȱ仯�����ߣ�����ͼ��ʾ��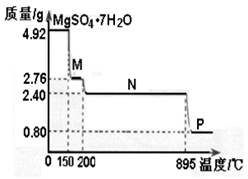
�ٹ���M�Ļ�ѧʽΪ__________��
������þ��������ʧȥ�ᾧˮ�Ĺ��̷�Ϊ_________���Ρ�
��Nת����Pʱ��ͬʱ������һ��������÷�Ӧ�Ļ�ѧ����ʽΪ_________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com