
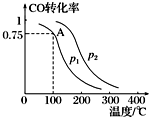
 利用CO和H2可以合成甲醇,反应原理为CO(g)+2H2(g)═CH3OH(g).一定条件下,在容积为V L的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如图所示.
利用CO和H2可以合成甲醇,反应原理为CO(g)+2H2(g)═CH3OH(g).一定条件下,在容积为V L的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如图所示.分析 (1)相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大;
(2)根据图可知,在A点,CO的转化率为0.75,所以平衡时n(CO)=amol×(1-0.75)=0.25amol,n(CH3OH)=c(CO)(参加反应)=amol×0.5=0.75amol,n(H2)=2amol-2×amol×0.75=0.5amol,则c(CO)=$\frac{0.25a}{V}$mol/L、c(CH3OH)=$\frac{0.75a}{V}$mol/L、c(H2)=$\frac{0.5a}{V}$mol/L,根据化学平衡常数K=$\frac{c(CH{\;}_{3}OH)}{c(CO)•c{\;}^{2}(H{\;}_{2})}$计算;
(3)反应物的物料之比等于反应方程式中的系数之比,则两种反应的转化率相等,据此判断
(4)影响反应速率的因素有温度、浓度、压强和催化剂,影响平衡移动的因素有温度、浓度和压强,据此分析.
解答 解:(1)甲醇的合成反应是分子数减少的反应,相同温度下,增大压强,平衡向正反应方向移动,则CO的转化率增大,根据图象知,p1<p2,
故答案为:<;甲醇的合成反应是分子数减少的反应,相同温度下,增大压强CO的转化率提高;
(2)根据图可知,在A点,CO的转化率为0.75,所以平衡时n(CO)=amol×(1-0.75)=0.25amol,n(CH3OH)=c(CO)(参加反应)=amol×0.5=0.75amol,n(H2)=2amol-2×amol×0.75=0.5amol,则c(CO)=$\frac{0.25a}{V}$mol/L、c(CH3OH)=$\frac{0.75a}{V}$mol/L、c(H2)=$\frac{0.5a}{V}$mol/L,所以K=$\frac{c(CH{\;}_{3}OH)}{c(CO)•c{\;}^{2}(H{\;}_{2})}$=$\frac{\frac{0.75a}{V}}{\frac{0.25a}{V}×({\frac{0.5a}{V})}^{2}}$=$\frac{12{V}^{2}}{{a}^{2}}$,
故答案为:$\frac{12{V}^{2}}{{a}^{2}}$;
(3)反应物的物料之比等于反应方程式中的系数之比,则两种反应的转化率相等,该反应中反应物CO 和H2的系数之比为1:2,等于投入的物料之比,所以CO 和H2的转化率相等,
故答案为:=;
(4)a.使用高效催化剂,反应速率加快,但平衡不移动,故不选;
b.降低反应温度,反应速率减慢,故不选;
c.增大体系压强,反应速率加快,平衡正向移动,CO的转化率增大,故选;
d.不断将CH3OH从反应混合物中分离出来,反应速率减慢,故不选;
故答案为:C.
点评 本题考查了化学平衡常数表达式书写以及计算、化学平衡影响因素分析判断、化学平衡状态的判断,掌握基础是关键,题目难度中等.


 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 开启啤酒瓶后,瓶中立刻泛起大量泡沫 | |
| B. | 500℃左右比在室温时更有利于提高合成氨的转化率 | |
| C. | 硫酸工业中,将黄铁矿粉碎后加入沸腾炉中 | |
| D. | 对2HI?H2+I2平衡体系增加压强使颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氮元素及其化合物在生产、生活中有着广泛的应用.
氮元素及其化合物在生产、生活中有着广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 滴定次数 | 待测溶液 体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的 刻度(mL) | ||
| 第①次 | 10.00 | 0.40 | 20.50 |
| 第②次 | 10.00 | 4.10 | 24.00 |
| 第③次 | 10.00 | 2.20 | 23.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com