
【题目】下列说法正确的是
A. 根据反应Cu+H2SO4![]() CuSO4+H2↑可推出Cu的还原性比H2的强
CuSO4+H2↑可推出Cu的还原性比H2的强
B. 电解含Pb(NO3)2和Cu(NO3)2的溶液,阴极上阳离子得电子次序依次是Cu2+、H+、Pb2+
C. 含amolNa2S的溶液最多能吸收2.5amol的二氧化硫气体(不考虑SO2在水中的溶解)
D. 由置换反应I2+2NaClO3===2NaIO3+Cl2可知I2的氧化性强于Cl2的氧化性
【答案】C
【解析】
A.因为该反应是非自发的,不能根据反应Cu+H2SO4![]() CuSO4+H2↑推出Cu还原性比H2强的结论,A项错误;
CuSO4+H2↑推出Cu还原性比H2强的结论,A项错误;
B.因为该溶液中H+浓度很小,此时H+得电子能力比Pb2+弱,所以阴极上阳离子得电子次序依次是Cu2+、Pb2+、H+,B项错误;
C.Na2S中硫元素显-2价,SO2中硫元素显+4价,Na2S与SO2发生归中反应生成S,若使amolNa2S溶液吸收SO2最多,则Na2S完全转化为S和NaHSO3,发生反应的化学方程式为2Na2S+5SO2+2H2O=3S↓+4NaHSO3,根据化学计量数知amol:n(SO2)=2:5,所以n(SO2)=2.5amol,
C项正确;
D.反应I2+2NaClO3===2NaIO3+Cl2中碘元素化合价由I2的0价升高到NaIO3中的+5价,I2失去电子是还原剂,表现还原性,所以I2的氧化性弱于Cl2,D项错误;答案选C。


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:
【题目】下列有关烷烃的叙述中,不正确的是
A. 在烷烃分子中,所有的化学键都为单键
B. 所有的烷烃在光照条件下都能与Cl2发生取代反应
C. 如图所示,将1体积甲烷和4体积Cl2充入试管中,一段时间后,将看到水槽底部有油状液滴生成,试管内充满水
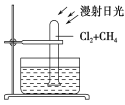
D. 甲烷与Cl2在光照条件下发生反应的产物中,HCl的浓度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“乙醇催化氧化”的实验装置如图所示:
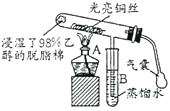
实验操作为:预先使棉花团浸透乙醇,并照图安装好仪器,在铜丝的中间部位加热片刻后,用气囊有节奏地鼓入空气,即可观察到以下明显的实验现象。
请回答以下问题:
(1)在实验过程中铜丝出现红色和黑色交替的现象,说明在该实验过程中催化剂_________![]() 填“参与了”或“没有参与”
填“参与了”或“没有参与”![]() 化学反应;写出乙醇催化氧化反应的化学方程式_________。
化学反应;写出乙醇催化氧化反应的化学方程式_________。
(2)在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明乙醇催化氧化反应是____反应。
(3)B中用蒸馏水收集到的物质可能有__________![]() 填物质的名称
填物质的名称![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,A、F为石墨电极,B、E为铁片电极。按要求回答下列问题。

(1)打开K2,合并K1。B为________极,A的电极反应为________________________。最终可观察到的现象是___________________________________________。
涉及的化学反应方程式有_______________________________。
(2)打开K1,合并K2。E为________极,F极的电极反应为_____,检验F极产生气体的方法是____________________________。
(3)若往U形管中滴加酚酞,进行(1)(2)操作时,A、B、E、F电极周围能变红的是________,原因是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分NaClO)。一化学小组在室温下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO3-等离子的物质的量(mol)与反应时间t(min)的关系曲线。下列说法不正确的是
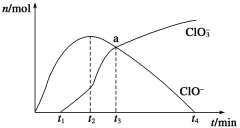
A. 工业制取漂白液的化学反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O
B. a点时溶液中各离子浓度:c(Na+)>c(Cl-)>c(ClO3-)=c(ClO-)>c(OH-)>c(H+)
C. t2~t4,ClO-离子的物质的量下降的原因可能是3ClO-= 2Cl-+ClO3-
D. 使用漂白液时,为了增强漂白效果,可以向漂白液中加入浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:
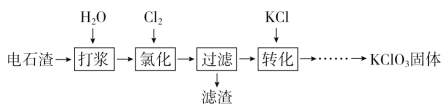
(1)氯化过程控制电石渣过量、在75 ℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2。
①电石与H2O反应的化学方程式为___________________。生成Ca(ClO)2的化学方程式为___________________。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有________(填序号)。
A.适当加快通入Cl2速率
B.充分搅拌浆料
C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2转化为Ca(ClO3)2的总反应方程式为:6Ca(OH)2+6Cl2===Ca(ClO3)2+5CaCl2+6H2O,氯化完成后过滤。
75 ℃时 Ca(ClO)2进一步转化为Ca(ClO3)2的反应方程式为__________________。
滤渣的主要成分为________(填化学式)。
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3的原因是________。
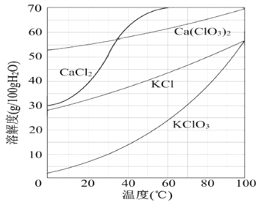
若溶液中KClO3的含量为100 g·L-1,从该溶液中尽可能多地析出KClO3固体的方法是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。
请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
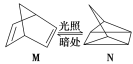 ΔH=+88.6 kJ·mol-1
ΔH=+88.6 kJ·mol-1
则M、N相比,较稳定的是 。
(2)已知CH3OH(l)的燃烧热为238.6 kJ·mol-1,CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a 238.6(填“>”、“<”或“=”)。
O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a 238.6(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式: 。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com