

| A. | 在通常情况下氯气比空气重 | |
| B. | 点燃是使氯气和氢气化合的唯一条件 | |
| C. | 氯气跟铁反应生成FeCl2 | |
| D. | 将红热的铜放入氯气中生成蓝色氯化铜 |
分析 A、根据相对分子质量的大小比较气体的密度大小;
B、氯气和氢气化合的条件是光照或是点燃;
C、氯气氧化性强,能将变价金属氧化为最高价;
D、金属铜在氯气中燃烧,得到棕黄色的烟,产物是氯化铜.
解答 解:A、氯气的相对分子质量大于空气的平均分子量,根据相对分子质量的大小,得到在通常情况下氯气比空气重,故A正确;
B、氯气和氢气化合的条件是光照或是点燃,故B错误;
C、氯气氧化性强,能将变价金属氧化为最高价,氯气跟铁反应生成FeCl3,故C错误;
D、金属铜在氯气中燃烧,得到棕黄色的烟,产物是氯化铜,其溶液才是蓝色的,故D错误.
故选A.
点评 本题考查学生氯气的性质知识,注意知识的归纳和梳理是关键,难度不大.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L溶液中含阴、阳离子总数是0.6 NA | |
| B. | 500 mL溶液中Ba2+的浓度是0.2 mol•L-1 | |
| C. | 500 mL溶液中NO-3的浓度是0.4 mol•L-1 | |
| D. | 1 L溶液中含有0.2 NA个NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶有1molFe(OH)3的胶体中,含有NA个Fe(OH)3胶粒 | |
| B. | 在标准状况下,22.4L水的分子数为NA | |
| C. | 常温常压下,14 gC2H4和 C3H6 的混合物含有的氢原子数为2NA | |
| D. | 1molFe与足量Cl2反应,铁失去电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 41.3% | B. | 8.7% | C. | 1.74% | D. | 2.14% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化钠的电子式: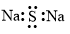 | |
| B. | HClO4的电离方程式:HClO4?H++ClO4- | |
| C. | 乙酸的结构简式:C2H4O2 | |
| D. | Mg2+的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量铁在氯气中反应,1mol铁失去的电子数为3NA | |
| B. | 6.4g Cu与足量硫充分反应后,转移电子数为0.2NA | |
| C. | 密闭容器中2mol NO与1mol O2充分反应后,产物的分子数为NA | |
| D. | 常温常压下,0.1mol NH3与0.1mol HCl充分反应后所得产物含0.1NA个分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
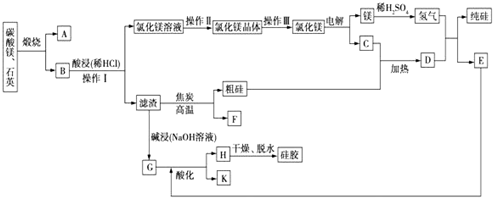
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com