
����Ŀ��ij�о���ѧϰС������ȷ�Ӧʵ��չ���о������и��л�ѧ�̲��ж������ȷ�Ӧ��������������������������Ӧ�ų��������ȣ�������ҫ�۵Ĺ�â������ֽ©�����²����մ���������������ɳ���������ġ���ѧ�ֲᡷ֪��Al��Al2O3��Fe��Fe2O3�۵㡢�е��������£�
���� | Al | Al2O3 | Fe | Fe2O3 |
�۵�/�� | 660 | 2054 | 1535 | 1462 |
�е�/�� | 2467 | 2980 | 2750 | -- |
������1��ijͬѧ�Ʋ⣬���ȷ�Ӧ���õ���������Ӧ�������Ͻ������ǣ��÷�Ӧ�ų�������ʹ���ۻ����������۵�����ͣ���ʱҺ̬���������ۺ��γ������Ͻ�����Ϊ���Ľ����Ƿ��������_____ ��������������������������
��2�����һ����ʵ�鷽����֤���������õĿ�״�������к��н���������ʵ�������Լ���_____ ����Ӧ�����ӷ���ʽΪ____ __��
��3��ʵ�����ܽ������������Լ�����õ���___ ___������ţ���
A��Ũ���� B��ϡ���� C��ϡ���� D������������Һ
����ʵ���о����֣����ᷢ��������ԭ��Ӧʱ�������Ũ��Խϡ����Ӧ��ԭ�����е�Ԫ�صĻ��ϼ�Խ�͡�ijͬѧȡһ������������������һ������ϡ�������ַ�Ӧ����Ӧ������������ų����ڷ�Ӧ���������Һ�У���μ���4molL-1������������Һ����������������Һ�������mL��������ij��������ʵ�����mol���Ĺ�ϵ��ͼ��ʾ���Իش��������⣺
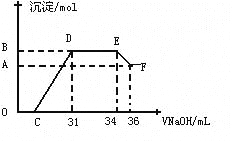
��4��ͼ��OC��û�г������ɣ��˽η�����Ӧ�����ӷ���ʽΪ____ __
��5����DE�Σ����������ʵ���û�б仯����˽η�����Ӧ�����ӷ���ʽΪ____ _ ����������˵����Һ��_____ _���OH����������___ ___ǿ�������ӷ��ţ���
��6��B���Ӧ�ij��������ʵ���Ϊ____ __mol��C���Ӧ������������Һ�����Ϊ____ __mL��
���𰸡�����1������
��2��NaOH��Һ��2Al+2OH��+H2O=2AlO2��+3H2����
��3��B��
����4��H++OH���TH2O
��5��NH4++OH���TNH3H2O��Al3+��Fe3+��H+��NH4+��
��6��0.032��7��
���������������������1�������۵�����ͣ���������Һ̬��һ����䵽ʢ��ɳ�ӵ��������γɺϽ��������ȷ�Ӧ���õ����������������Ͻ����Ժ�������2����������������Һ��Ӧ�������壬���Կ������������Ƽ������õ����������Ƿ���������Ӧ����ʽΪ2Al+2OH��+H2O=2AlO2��+3H2������3��A��Ũ������ʹ�����ۻ�������ʹ�Ͻ��ܽ⣬����B�����ý�����ϡ���ᷴӦ����������ܽ���ϡ�����У���ȷ��C��ϡ�����������Ӧ������Ⱦ�����壬�������ѡ����D���������������Ʒ�Ӧ�����ܽ�������ȫ���ܽ⣬��������ѡB������4��O��C֮�䷢���ķ�Ӧ������кͷ�Ӧ�����ӷ���ʽΪH++OH���TH2O ����5��DEһ�γ���������û�б仯���÷�ӦΪ笠����������������ӽ������һˮ�ϰ�������ʽΪNH4++OH���TNH3H2O����������˵����Һ�����Ƚ�����������ӵ��������ӣ�Ȼ��Ϊ�����Ӻ������ӣ���������������ӵ���笠����ӣ�������Һ�е����ӽ�����������ӵ�������ǿ���������ӣ�������Ϊ笠����ӡ���6����ͼ��֪��EF�����ĵ�����������ҺΪ36-34=2mL���ü���μ���Ӧ���������Ƶ����ʵ���Ϊ0.002��4=0.008mol�����ݷ���ʽ���㣬�������������ʵ���Ϊ0.008Ħ������������������Ϊ0.008Ħ��������Ϊxmol����Ϊ0.008mol�����ɵ������Ϊ��34-31����0.001��4=0.012mol�������������������Ӧ�������������ɵ����غ������3x+0.008��3=0.012��3 x=0.024mol������Ӧ�����������������ʵ���Ϊ0.024mol�����ɳ����������ʵ���Ϊ0.008+0.024=0.032mol���μ������������Ϊ31mLʱ�������Ӻ������Ӻ������Ӷ���Ӧ����C������������Һ�����Ϊ0.031-0.024��3/4-0.008��3/4="0.00" 7L����7mL��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Fe(OH)3������Ʊ�ʵ�飺��_____________����μ���______________________��Һ�������������Һ��______________ɫ��ֹͣ���ȡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У�Ũ����ȱ���ǿ�����ԣ��ֱ������Ե���
��2NaC1(��)+ H2SO4(Ũ) ![]() Na2SO4+2HC1��
Na2SO4+2HC1��
��C +2H2SO4(Ũ) ![]() CO2��+ 2SO2��+2H2O
CO2��+ 2SO2��+2H2O
��Cu+2H2SO4(Ũ) ![]() CuSO4+ SO2��+2H2O
CuSO4+ SO2��+2H2O
��2FeO+4H2SO4(Ũ)=Fe2(SO4)3+SO2��+4H2O
A. �٢� B. �ۢ� C. �٢� D. �ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ԭ�Ӿ�����ͬ������������У�������
A.Na+
B.F��
C.Al3+
D.S2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������PM2.5���ѳ�Ϊ���ӡ������ȴʣ��������������ϡ������Ѻá����ǣ� ��
A.ʹ�������Դ������ú��ȼ��
B.���ύͨѹ�����ᳫ˽�ҳ�����
C.��·���������ض�������ˮ�������ﳾ
D.��ֲɳĮ�����֣�����ɳ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵����ȷ���ǣ� ��
A.����ƿʹ��ǰ�����������������
B.����ʵ���������ֹͣͨ����ˮ����ֹͣ����
C.������ķ�Һ����ˮ�ۣ���ˮ������ˮ��
D.�������ƾ��ƴ�������ʧ��ʱ��������ʪĨ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʼ��ת����ͨ��һ����Ӧ����ʵ�ֵ��ǣ� ��
A.CO2��Na2CO3
B.FeCl3��FeCl2
C.H2SiO3��Na2SiO3
D.S��SO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
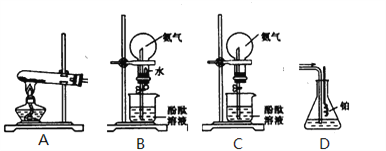
����Ŀ����ͼ��ʾ��ѧ������С����Ƶ���ȡ���������а�������ˮ����Ȫʵ��������װ��ʾ��ͼ
��ش��������⣺
(1)ѧ������ͼA��ʾװ���Ʊ�������д���÷���ȡ�����Ļ�ѧ����ʽ_________________________���Ƴ��İ���Ӧʹ��________�����ռ���Ҫ�õ�����İ�����ѡ��___________���������
(2)ѧ������ͼB��ʾװ�ý�����Ȫʵ�飬�ϲ���ƿ�ѳ������ﰱ��������ˮ����IJ�����________��
(3)ѧ������װ��B��װΪװ��C������ͬѧ���ۺ���ΪҲ��������Ȫ����˵���ø�װ��������Ȫ�ķ���____________________��
(4)ѧ������װ��D����һ��ʱ�䰱������ͨ�������ͬʱ�������ȵIJ�˿����װ��D����ƿ�ڣ������˾��д����õIJ�˿�����������ֺ��ȣ�ͬʱƿ�������˺���ɫ�����塣д���ڴ˹����п��ܷ�����Ӧ�Ļ�ѧ����ʽ________________________,____________________________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪʵ����ijŨ�����Լ�ƿ��ǩ�ϵ��й����ݣ��Ը��ݱ�ǩ�ϵ��й����ݻش��������⣺
����
����ʽ��HCl
��Է���������36.5
�ܶȣ�1.19 g��cm-3
HCl������������36.5%
��1����Ũ������HCl�����ʵ���Ũ��Ϊ_________mol��L ��1 ��
��2��ȡ����������ĸ�������Һʱ�������������в�����ȡ����Ķ��ٶ��仯����________��
A����Һ��HCl�����ʵ��� B����Һ��Ũ��
C����Һ��Cl�� ����Ŀ D����Һ���ܶ�
��3��ijѧ��ȡ����Ũ����100mL��
������ˮϡ�͵�500 mL��������������ʵ���Ũ��Ϊ________mol��L ��1 ��
������ʹ����Һ������������Ϊԭ����![]() ��Ӧ�ü�______mL����ˮ��
��Ӧ�ü�______mL����ˮ��
������ʹ����Һ�����ʵ���Ũ�ȱ�Ϊԭ����![]() ���������ˮ�����______119mL���ÿ��>����<����=������
���������ˮ�����______119mL���ÿ��>����<����=������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com