
 A~E五种元素中,除E外均为短周期元素,且原子序数依次增大.它们的原子结构或性质如下表所示:
A~E五种元素中,除E外均为短周期元素,且原子序数依次增大.它们的原子结构或性质如下表所示:| 元素 | A | B | C | D | E |
| 结构或性质 | 原子半径最小的元素 | 地壳中含量最多的元素 | 可与B形成阴阳离子个数比为1:2的两种化合物 | 与B同主族 | 单质是生活中最常见的金属,可被磁铁吸引 |
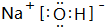 ,乙能促进水的电离,则乙为亚硫酸钠或硫氢化钠,化学式为Na2SO3或NaHS,
,乙能促进水的电离,则乙为亚硫酸钠或硫氢化钠,化学式为Na2SO3或NaHS,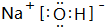 ;Na2SO3或NaHS;
;Na2SO3或NaHS;| 0.672L |
| 22.4L/mol |
| 0.168L |
| 22.4L/mol |
| 0.03mol×2-0.0075mol×4 |
| 6 |


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
| A、碳和水反应吸收131.3 kJ能量 |
| B、1 mol碳和1 mol水反应生成1 mol一氧化碳和1 mol氢气并吸收131.3 kJ热量 |
| C、1 mol固态碳和1 mol水蒸气反应生成1 mol一氧化碳气体和1 mol氢气并吸收131.3 kJ热量 |
| D、1个固态碳原子和1分子水蒸气反应吸热131.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
c(N
| ||
| c(NH3?H2O) |
| c(NH3?H2O) |
| c(OH-) |
| c(OH-) |
| c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 离子 | Al3+ | Fe3+ | Ni2+ |
| pH | 5.2 | 4.1 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHS在水中的电离方程式为:NaHS=Na++HS-和HS-=H++S2- |
| B、同物质的量浓度的氨水和盐酸反应至中性时所用体积:V(NH3?H2O)<V(HCl) |
| C、Na2SO3溶液中:c(H+)+c(HSO3-)+2c(H2SO3)=c(OH-) |
| D、同浓度的下列溶液中,c(CH3COO-)的大小:CH3COONa>CH3COONH4>CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
| B、将少量SO2通入苯酚钠溶液中:2C6H5O-+SO2+H2O=2C6H5OH+SO32- |
| C、用硫氰化钾溶液可以检验溶液中的Fe3+:Fe3++3SCN-=Fe(SCN)3↓ |
| D、向碘化亚铁溶液中通入过量的氯气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com