
【题目】下列几种物质氧化性由强到弱顺序如下:KMnO4>Cl2>FeCl3>I2。则除去FeCl2溶液中混有的I–应选用 ( )
A. KMnO4 B. Cl2 C. I2 D. FeCl3
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
【题目】下列反应最终能生成含三价铁的化合物的是
①过量Fe与HNO3 ② 铁丝在硫蒸汽中燃烧 ③过量的Fe在Cl2中燃烧
④铁与CuCl2溶液反应 ⑤Fe(OH)2露置于空气中
A.①②③ B.①③⑤ C.③④ D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有5 种短周期元素的原子序数按E、D、B、A、C的顺序依次增大;A、C同周期,B、C同主族;A与B可形成离子化合物A2B,A2B中所有粒子的电子数相同,且电子总数为30;D和E可形成4核10电子的分子。试回答下列问题:
(1)写出五种元素的名称:A B C D 。
(2)用电子式表示离子化合物A2B的形成过程:
(3)写出下列物质的电子式:
D元素形成的单质 ;B与E形成的化合物 ;
A、B、E形成的化合物 ;D、E形成的化合物 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. ![]() U是重要的核工业原料,在自然界的丰度很低。
U是重要的核工业原料,在自然界的丰度很低。![]() U的浓缩一直为国际社会关注。回答下列有关问题:
U的浓缩一直为国际社会关注。回答下列有关问题:
(1)![]() U表示的含义是________________。
U表示的含义是________________。
(2)![]() U、
U、![]() U、
U、![]() 互为同位素,下列对同位素的理解不正确的是________(填序号,下同)。
互为同位素,下列对同位素的理解不正确的是________(填序号,下同)。
A.元素符号相同 B.物理性质相同
C.化学性质基本相同 D.在周期表中位置相同
(3)下列有关![]() U说法不正确的是________。
U说法不正确的是________。
A.![]() U原子核的中子数与质子数之差为51
U原子核的中子数与质子数之差为51
B.![]() U与
U与![]() U的质子数、电子数都相等
U的质子数、电子数都相等
C.![]() U与
U与![]() U是两种质子数相同,中子数不同的原子
U是两种质子数相同,中子数不同的原子
D.![]() U与
U与![]() U是同种原子
U是同种原子
Ⅱ.锂的材料在社会生活中广泛应用,如亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,LiCoO2作便携式电源的正极材料,碳酸锂(Li2CO3)广泛应用于陶瓷和医药等领域。根据下列要求回答相关问题:
(1)Li和Li作核反应堆最佳载热体,LiH和LiD作高温堆减速剂。下列说法中 正确的是________(填序号,下同)。
A.Li和Li互为同位素 B.Li和Li属于同种核素
C.LiH和LiD的化学性质不同 D.LiH和LiD是同种物质
(2)下列说法不正确的是________。
A.碱性:Be(OH)2<LiOH<NaOH<KOH B.半径:K>Na>Li>Li+
C.氧化性:Li+<Na+<K+<Rb+<Cs+ D.金属性:Cs>Rb>K>Na>Li>Be
(3)锂是碱金属族首元素,其性质明显不同于其他碱金属性质,下列能支持这一观点的性质是________。
A.碱金属与水反应 B.碱金属在氧气中燃烧
C.碱金属与氢气反应 D.碱金属与氯气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈元素(Ce)是镧系金属中自然丰度最高的一种,常见价态有+3、+4,铈的合金耐高温,可以用来制造喷气推进器零件。
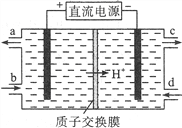
(1)雾霾中含有大量的污染物NO,可以被Ce4+溶液吸收,生成NO2-、NO3-(二者物质的量之比为1∶1),该反应氧化剂与还原剂的物质的量之比为___________。
(2)可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如右图所示。
①Ce4+从电解槽的__________(填字母序号)口流出。
②写出阴极的电极反应式____________________________。每消耗1mol NO2-,阴极区H+物质的量减少______mol。
(3)铈元素在自然中主要以氟碳矿形式存在,主要化学成分为CeFCO3,工业上利用氟碳铈矿提取CeCl3的一种工艺流程如下:
①焙烧过程中发生的主要反应方程式为______________________________________。
②酸浸过程中有同学认为用稀硫酸和H2O2替换盐酸更好,他的理由是_________________________。
③Ce(BF4)3、KBF4的Ksp分别为a、b,则Ce(BF4)3(s) + 3KCl(aq)![]() 3KBF4(s) + CeCl3 (aq)平衡常数为______________________。
3KBF4(s) + CeCl3 (aq)平衡常数为______________________。
④加热CeCl3·6H2O和NH4Cl的固体混合物可得到无水CeCl3,其中NH4Cl的作用是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒容密闭容器中存在下列平衡:CO(g)+H2O(g)![]() CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如右图所示。下列说法错误的是
CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如右图所示。下列说法错误的是

A. 在T2时,若反应进行到状态D,则一定有v正<v逆
B. 平衡状态A与C相比,平衡状态A的c(CO)小
C. 若T1、T2时的平衡常数分别为K1、K2,则K1<K2
D. 反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的△H>0
CO2(g)+H2(g)的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,化学键类型相同,晶体类型也相同的是 ( )
A. C(金刚石)和CO2 B. NaBr和HBr C. CH4和H2O D. Cl2和KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1mol H2(g)和2mol I2(g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+ I2(g) ![]() 2HI(g) △H<0,达平衡,HI的体积分数ω(HI)随时间变化如图Ⅱ所示,若改变反应条件,ω(HI)的变化曲线如图Ⅰ所示,则改变的条件可能是( )
2HI(g) △H<0,达平衡,HI的体积分数ω(HI)随时间变化如图Ⅱ所示,若改变反应条件,ω(HI)的变化曲线如图Ⅰ所示,则改变的条件可能是( )

A.恒温恒容条件下,加入适当催化剂
B.恒温条件下,缩小反应容器体积
C.恒温条件下,扩大反应容器体积
D.恒容条件下升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸H2A在水中的电离方程式是H2A=H++HA-,HA-![]() H++A2-。回答下列问题:
H++A2-。回答下列问题:
(1) Na2A溶液显 (填“酸性”、“中性”或“碱性”),理由是 (用离子方程式或必要的文字说明)。
(2) 常温下,已知0.1 mol·L-1NaHA溶液pH=2,则0.1 mol·L-1H2A溶液中氢离子的物质的量浓度可能 0.11 mol·L-1(填“大于”、“等于”或“小于”), 理由是 。
(3) 0.1 mol·L-1NaHA溶液中各种离子浓度由大到小的顺序是
(4) Na2A溶液中,下列表述正确的是
A.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
B.c(Na+)=2[c(HA-)+c(A2-)+c(H2A)]
C.c(OH-)=c(HA-)+c(H+)+2c(H2A)
D.c(OH-)=c(HA-)+c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com