
科目:高中化学 来源: 题型:选择题
| A. | SiO2是沙子的主要成分,纯净的SiO2是光纤制品的基本原料 | |
| B. | 水晶的基本结构单元是[SiO4]四面体结构 | |
| C. | 将游离态的氮转变为氮的化合物就是氮的固定,合成氨是一种人工固氮方法 | |
| D. | 将等物质的量的氯气和二氧化硫同时通入品红溶液中,褪色比二氧化硫通入品红溶液快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
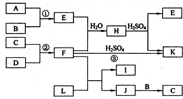 图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体.(b)反应①、②是化工生产中的重要反应.(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥.(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得.(e)化合物J由两种元素组成,其相对分子质量为32.
图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体.(b)反应①、②是化工生产中的重要反应.(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥.(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得.(e)化合物J由两种元素组成,其相对分子质量为32.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 合成氨需用铁触媒加快反应速率 | |
| B. | 高压比常压有利于合成SO3的反应 | |
| C. | 由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 | |
| D. | 收集氯气可用排饱和食盐水法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
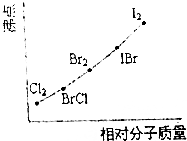 (1)在已知存在H2、Cl2、I2、HCl和Hl的时代,根据原子通过共价键形成分子的基本特点(如下图),推测还可能存在的一种化合物(A),其化学式为ICl.
(1)在已知存在H2、Cl2、I2、HCl和Hl的时代,根据原子通过共价键形成分子的基本特点(如下图),推测还可能存在的一种化合物(A),其化学式为ICl. | H- | Cl- | I- | |
| -H | H-H | H-Cl | H-I |
| -Cl | H-Cl | Cl-Cl | |
| -I | H-I | I-I |
| 反应物 | 化合物(A) | Br2 |
| Na | 2Na+Br2=2NaBr | |
| H2 | H2+Br2=2HBr | |
| H2O | H2O+Br2?HBr+HBrO | |
| Kl | 2Kl+Br2=I2+2KBr |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
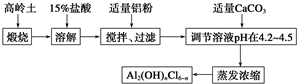
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
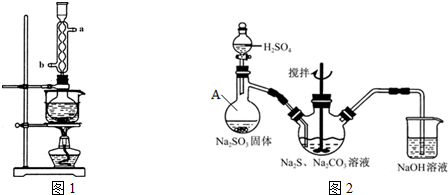
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
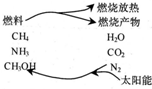
| A. | 化学能 | B. | 热能 | C. | 生物能 | D. | 电能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com