
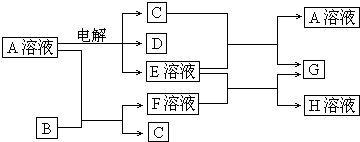
| ||
| 0.16 |
| 8 |
| 0.02mol |
| 0.1L |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、烧瓶、锥形瓶、量筒加热时均需垫上石棉网 |
| B、新制氯水保存在棕色细口瓶中,并放在阴凉处 |
| C、将蓝色硫酸铜晶体放入浓硫酸属于物理变化 |
| D、化石燃料属于可再生能源,不影响可持续发展 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁分别加入浓硫酸和氢氧化钠溶液中均无明显现象 |
| B、SO2既能使品红褪色也能使酸性高锰酸钾褪色 |
| C、漂白粉溶液和硅酸钠溶液久置空中都变质 |
| D、H2O2溶液中加入MnO2或FeCl3溶液都能增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| B、pH=4的醋酸稀释l0倍,溶液中c(CH3COOH)、c(OH-)均减小 |
| C、常温下向CH3COONa溶液中加入适量CH3COOH溶液,使混合液的pH=7,则混合液中c(Na+)=c(CH3COO-) |
| D、等浓度的弱酸HA溶液和NaOH溶液等体积混合,所得混合液显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
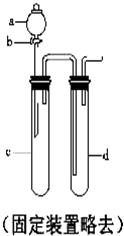 铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境,改进实验的涉及符合绿色化学的思想.有兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化.
铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境,改进实验的涉及符合绿色化学的思想.有兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化.| 方案 | 反应物 |
| 甲 | Cu、浓硝酸 |
| 乙 | Cu、稀硝酸 |
| 丙 | Cu、O2、稀硝酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com