
25℃时,下列关于分别由等体积0.1 mo1/L的2种溶液混合而成的溶液的说法中,不正确的是 ( )
A.Ba(OH)2溶液与Na2SO4溶液:pH=13
B.醋酸与CH3COONa溶液:c(Na+)+c(H+)=c(CH3COO一)+c(OH一)
C.Na2CO3溶液与NaOH溶液:c(Na+)>c( CO)>c(OH一)>c(H+)
D.Na2CO3溶液与NaHCO3溶液:2c(Na+)=3c(CO)+3c(HCO)+3c(H2CO3)
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
(共14分)实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g)CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.DH>0,DS>0 B.DH>0,DS<0 C.DH<0,DS<0 D.DH<0,DS>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH) = mol·(L·min)-1;
H2的转化率w(H2)=
②该反应的平衡常数表达式K=
③下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.升高温度 B.将CH3OH(g)及时液化抽出
C.选择高效催化剂 D.再充入l molCO2和3 molH2
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出表示CH3OH燃烧热的热化学方程式:
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极电极反应式
查看答案和解析>>
科目:高中化学 来源:2011-2012学年年天津市塘沽一中等三校高二上学期期末联考化学试卷 题型:填空题
(共14分)实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化: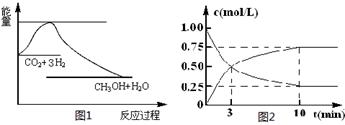
(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.DH>0,DS>0 B.DH>0,DS<0 C.DH<0,DS<0 D.DH<0,DS>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH) = mol·(L·min)-1;
H2的转化率w(H2) =
②该反应的平衡常数表达式K=
③下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.升高温度 B.将CH3OH(g)及时液化抽出
C.选择高效催化剂 D.再充入l molCO2和3 molH2
(3)25℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出表示CH3OH燃烧热的热化学方程式:
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极电极反应式
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省嘉兴市高三教学测试(一)理综化学试卷(解析版) 题型:实验题
芳香族羧酸通常用芳香烃的氧化来制备。芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基。某同学用甲苯的氧化反应制备苯甲酸 。反应原理:

反应试剂、产物的物理常数:
名称 | 相对分子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
水 | 乙醇 | 乙醚 | ||||||
甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | ∞ | ∞ |
苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
主要实验装置和流程如下:

图1回流搅拌装置 ???? ???????????????? 图2抽滤装置
实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在100℃时, 反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。

(1)仪器K的名称为????? 。无色液体A的结构简式为????? 。操作Ⅱ为????? 。
如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是????? 。
(3)下列关于仪器的组装或者使用正确的是????? 。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌棒下端不能与三颈烧瓶底、温度计等接触
C.抽滤结束后,为防止倒吸,应先关闭水龙头,再断开真空系统与过滤系统的连接
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入????? ,分液,水层再加入????? ,然后抽滤,干燥即可得到苯甲酸。
(5)纯度测定:称取1.220g产品,配成100ml溶液,取其中25.00ml溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3mol。产品中苯甲酸质量分数为????? 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省盟校十校联考高三第一次联考理综化学试卷(解析版) 题型:实验题
苯甲酸乙酯(C9H10O2)别名为安息香酸乙酯。 它是一种无色透明液体,不溶于水,稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体,溶剂等。其制备方法为:

已知:
名称 | 相对分子质量 | 颜色,状态 | 沸点(℃) | 密度(g·cm-3) |
苯甲酸* | 122 | 无色片状晶体 | 249 | 1.2659 |
苯甲酸乙酯 | 150 | 无色澄清液体 | 212.6 | 1.05 |
乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
*苯甲酸在100℃会迅速升华。
实验步骤如下:
①在圆底烧瓶中加入12.20 g苯甲酸,25 mL 95%的乙醇(过量),20 mL环己烷以及4 mL浓硫酸,混合均匀并加入沸石,按下图所示装好仪器,控制温度在65~70℃加热回流2 h。利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
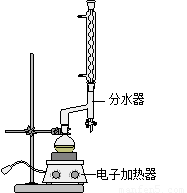
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞,继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液至呈中性。用分液漏斗分出有机层,水层用25 mL乙醚萃取分液,然后合并至有机层,加入氯化钙,静置,过滤,对滤液进行蒸馏,低温蒸出乙醚和环己烷后,继续升温,接收210~213℃的馏分。
④检验合格,测得产品体积为12.86 mL。
回答下列问题:
(1)在该实验中,圆底烧瓶的容积最适合的是????????? (填入正确选项前的字母)。
A.25 mL?? ?? B.50 mL? ?? ? C.100 mL? ?? ? D.250 mL
(2)步骤①中使用分水器不断分离除去水的目的是????????????????????? 。
(3)步骤②中应控制馏分的温度在???????????? 。
A.65~70℃???????? B.78~80℃????? C.85~90℃????? D.215~220℃
(4)步骤③加入Na2CO3的作用是?????????????????????? ;若Na2CO3加入不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是????????????????????????????????????? ?? 。
(5)关于步骤③中的萃取分液操作叙述正确的是??????????
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔
(6)计算本实验的产率为??????????????? 。
查看答案和解析>>
科目:高中化学 来源:2010年湖南浏阳一中高一上学期期中考试化学试卷 题型:选择题
右图为农夫山泉矿泉水瓶上的部分说明文字,列出了该饮用天然水理化指标。这里的钙、镁、钾、钠是指
|
饮用天然水理化指标 矿物元素 测定结果 钙≥4.0 mg/L 镁≥0.5 mg/L 钾≥0.35 mg/L 钠≥0.8 mg/L 偏硅酸≥1.8 mg/L pH (25℃) 7.1
【答案】D 【解析】略 【题型】选择题 【适用】较易 【标题】2010年湖南浏阳一中高一上学期期中考试化学试卷 【关键字标签】农夫山泉,指标 【结束】 3【题文】下列实验操作中,错误的是
【答案】D 【解析】略 【题型】选择题 【适用】较易 【标题】2010年湖南浏阳一中高一上学期期中考试化学试卷 【关键字标签】实验操作 【结束】 4【题文】下列说法中正确的是
【答案】B 【解析】略 【题型】选择题 【适用】较易 【标题】2010年湖南浏阳一中高一上学期期中考试化学试卷 【关键字标签】分子数,原子数 【结束】 5【题文】下列有关0.2mol·L-1 BaCl2溶液的说法不正确的是
【答案】A 【解析】略 【题型】选择题 【适用】较易 【标题】2010年湖南浏阳一中高一上学期期中考试化学试卷 【关键字标签】溶液,离子浓度 【结束】 6【题文】下列离子方程式中书写正确的是( )
【答案】B 【解析】略 【题型】选择题 【适用】较易 【标题】2010年湖南浏阳一中高一上学期期中考试化学试卷 【关键字标签】离子方程式,氢氧化钡 【结束】 7【题文】已知有如下反应:①2Fe3++2I-===2Fe2++I2 ②2Fe2++Br2===2Fe3++2Br- ③2Fe(CN)+I2===2Fe(CN)+2I-,试判断氧化性强弱顺序正确的是
【答案】C 【解析】略 【题型】选择题 【适用】较易 【标题】2010年湖南浏阳一中高一上学期期中考试化学试卷 【关键字标签】氧化性,顺序 【结束】 8【题文】实验室制取少量N2常利用的反应是NaNO2+NH4ClNaCl+N2↑+2H2O,关于该反应的说法正确的是
【答案】A 【解析】略 【题型】选择题 【适用】较易 【标题】2010年湖南浏阳一中高一上学期期中考试化学试卷 【关键字标签】实验室,氧化剂 【结束】 9【题文】用托盘天平称量固体物质时,若将样品和砝码放在托盘上的位置颠倒,平衡时托盘上的砝码质量为10g,游码为0.5g,则样品的质量为
【答案】D 【解析】略 【题型】选择题 【适用】较易 【标题】2010年湖南浏阳一中高一上学期期中考试化学试卷 【关键字标签】托盘天平,砝码 【结束】 10【题文】将26克含有SiO2和CaCO3固体在高温下加热至质量不再改变,冷却后称重为17.2克。(已知:SiO2 + CaCO3 CaSiO3 + CO2↑,SiO2和CaSiO3均为固体) (1)求生成的CO2的体积(标准状况下) (2)求原混合物中所含SiO2的质量。 【答案】(1)4.48L (2)6克 【解析】略 【题型】计算题 【适用】较易 【标题】2010年湖南浏阳一中高一上学期期中考试化学试卷 【关键字标签】高温,体积 【结束】 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com