
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:![]() 已知
已知![]()
容器 | 甲 | 乙 | 丙 |
反应物的投入量 |
|
|
|
|
|
|
|
反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
体系的压强 |
|
|
|
反应物的转化率 |
|
|
|
下列说法正确的是![]()
![]()
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
【答案】B
【解析】甲容器内的平衡与乙容器内平衡是等效平衡, 所以平衡时NH3的浓度相等,即c1=c2,丙容器反应物投入量4molNH3,是乙的二倍,相当于增大压强,平衡正移,所以丙中氨气的浓度大于乙中氨气浓度的二倍,即c3>2c2,即c3>2c1,2P2>P3,![]() ,所以
,所以![]() .
.
A.甲容器内的平衡与乙容器内平衡是等效平衡, 所以平衡时NH3的浓度相等,即c1=c2,丙容器反应物投入量4molNH3,是乙的二倍,相当于增大压强,平衡正移,所以丙中氨气的浓度大于乙中氨气浓度的二倍,即c3>2c2,即c3>2c1,A错误;
B.乙中开始投入2molNH3,则甲与乙是等效的,甲与乙的反应的能量变化之和为92.4kJ,故a+b=92.4,B正确;
C.丙容器反应物投入量4molNH3,是乙的二倍,反应起始时2P2=P3,由于合成氨的反应是气体体积减小的反应,故2P2>P3,C错误;
D.丙容器反应物投入量4molNH3,是乙的二倍,相当于增大压强,平衡向右移动,所以丙中氨的转化率比乙小,因为![]() ,所以
,所以![]() ,D错误。
,D错误。
本题选B .


科目:高中化学 来源: 题型:
【题目】下列关于物质分类的说法正确的是( )
A.糖水、豆浆都属于溶液B.血液、墨水都属于胶体
C.分解反应都属于氧化还原反应D.氢气还原氧化铜属于离子反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含![]() 废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的
废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的![]() 和
和![]() 可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室
可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室![]() 下列叙述正确的是
下列叙述正确的是![]()
![]()
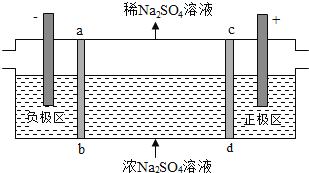
A. 通电后中间隔室的![]() 离子向正极迁移,正极区溶液pH增大
离子向正极迁移,正极区溶液pH增大
B. 该法在处理含![]() 废水时可以得到NaOH和
废水时可以得到NaOH和![]() 产品
产品
C. 负极反应为![]() ,负极区溶液pH降低
,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有![]() 的
的![]() 生成
生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有8种元素的性质、数据如下表所列,它们属于第二或第三周期。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
-2 | -3 | -1 | -3 |
回答下列问题:
(1) ③的元素符号是_________,⑧的元素名称是_________。①在元素周期表中的位置是 (周期、族)_________________________________。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是___________;碱性最强的化合物的电子式是:________________;属________化合物(填“离子”或“共价”
(3)比较④和⑦的氢化物的稳定性(用化学式表示)________________________。
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:________________。
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍配合物在传感器、磁记录材料、储氢材料、电极催化剂和化学键研究等方面有着广泛的应用。以纯镍片为原料制备一种镍配合物[Ni(NH3)xCly]Clz·nH2O的主要流程如下:
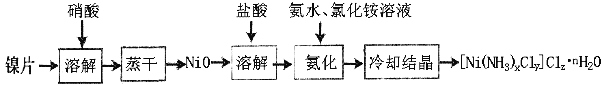
(1)工业上镍氢电池总反应式为:LaNi5H6 + NiOOH ![]() LaNi5 + Ni(OH)2,其中KOH作电解质溶液,负极电极反应式为:_______________________
LaNi5 + Ni(OH)2,其中KOH作电解质溶液,负极电极反应式为:_______________________
(2)常温下,镍投入60%的浓硝酸无明显现象,流程中需控制反应温度50-60oC,控温原因可能是_______,写出离子反应方程式:____________________________。
(3)冷却结晶后洗涤、过滤、干燥得到[Ni(NH3)xCly]Clz·nH2O,其中洗涤的正确操作是___________________________________________________________________。
(4)氨化过程中应控制溶液pH范围8~9,其原因是_____________________________。上述流程中,有关说法正确的是___________
A.氨化操作为在过量氨水和氯化铵缓冲溶液中,缓慢滴入酸化的NiCl2溶液,并不断搅拌
B.此缓冲溶液中微粒浓度大小顺序为:c(Cl—)> c(NH3·H2O) >c(NH4+) > c(OH—)> c(H+)
C.冷却结晶后的母液加适量氨水调节pH后可以循环利用
D.可以用热的浓硫酸和浓硝酸混合溶液代替浓硝酸溶解镍片
(5)为测定化合物[Ni(NH3)xCly]Clz·nH2O的组成,进行如下实验:
实验一:称取样品0.6460 g,加入过量的浓NaOH溶液,煮沸,冷却,蒸出的氨用40.00 mL 0.5000 mol·L-1的盐酸完全吸收,并用蒸馏水定容至100 mL,得溶液B。取B溶液20.00 mL,加入指示剂少量,用0.1000 mol·L-1NaOH滴定,消耗NaOH溶液20.00 mL。
实验二:另取该样品0.6460 g,溶于水,以0.1000 mol·L-1AgNO3溶液滴定至恰好反应完全,消耗AgNO3溶液20.00 mL。相应反应化学方程式为: [Ni(NH3)xCly]Clz+zAgNO3=[Ni (NH3)xCly] (NO3)z+zAgCl↓ 测得该镍配合物的化学式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬![]() 在溶液中主要以
在溶液中主要以![]() 蓝紫色
蓝紫色![]() 、
、![]() 绿色
绿色![]() 、
、![]() 橙红色
橙红色![]() 、
、![]() 黄色
黄色![]() 等形式存在,
等形式存在,![]() 为难溶于水的灰蓝色固体,回答下列问题:
为难溶于水的灰蓝色固体,回答下列问题:
(1)![]() 与
与![]() 的化学性质相似,在
的化学性质相似,在![]() 溶液中逐滴加入NaOH溶液直至过量,可察到的现象是 ______________________________________________ .
溶液中逐滴加入NaOH溶液直至过量,可察到的现象是 ______________________________________________ .
(2)![]() 和
和![]() 在溶液中可相互转化
在溶液中可相互转化![]() 室温下,初始浓度为
室温下,初始浓度为![]() 的
的![]() 溶液中
溶液中![]() 随
随![]() 的变化如图所示.
的变化如图所示.

![]() 用离子方程式表示
用离子方程式表示![]() 溶液中的转化反应______________________________ .
溶液中的转化反应______________________________ .
![]() 由图可知,溶液酸性增大,
由图可知,溶液酸性增大,![]() 的平衡转化率__________________
的平衡转化率__________________ ![]() 填“增大“减 小”或“不变”
填“增大“减 小”或“不变”![]() 根据A点数据,计算出该转化反应的平衡常数为 _______________ .
根据A点数据,计算出该转化反应的平衡常数为 _______________ .
![]() 升高温度,溶液中
升高温度,溶液中![]() 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的![]() ______
______ ![]() 填“大于”“小于”或“等于”
填“大于”“小于”或“等于”![]() .
.
(3)在化学分析中采用![]() 为指示剂,以
为指示剂,以![]() 标准溶液滴定溶液中的
标准溶液滴定溶液中的![]() ,利用
,利用![]() 与
与![]() 生成砖红色沉淀,指示到达滴定终点
生成砖红色沉淀,指示到达滴定终点![]() 当溶液中
当溶液中![]() 恰好完全沉淀
恰好完全沉淀![]() 浓度等于
浓度等于![]() 时,溶液中
时,溶液中![]() 为 ______
为 ______ ![]() ,此时溶液中
,此时溶液中![]() 等于 ______
等于 ______ ![]() 已知
已知![]() 、AgCl的
、AgCl的![]() 分别为
分别为![]() 和
和![]()
(4)![]() 价铬的化合物毒性较大,常用
价铬的化合物毒性较大,常用![]() 将废液中的
将废液中的![]() 还原成
还原成![]() ,反应的离子方程式为 _________________________________________________ .
,反应的离子方程式为 _________________________________________________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工厂排放的SO2烟气对环境造成污染,某企业用下图流程综合处理,下列有关说法正确的是

A. 二氧化硫吸收塔中发生的反应为SO2+SO32-+H2O=2HSO3-
B. 氨气吸收塔中发生的反应为HSO3-+OH-=H2O+SO32-
C. 上述流程利用的是氧化还原反应原理
D. 上述流程可循环利用的物质有2种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com