
 .
.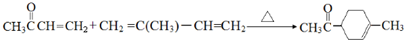 .
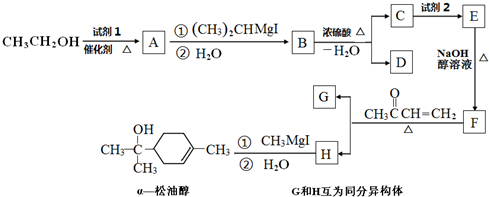
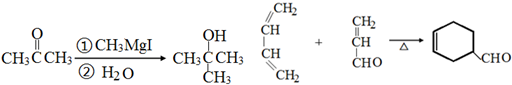
. 分析 由α-松油醇的结构、给予的反应信息,逆推可知H为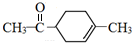 ,结合信息可知F为CH2=CH-C(CH3)=CH2,G与H互为同分异构体,则G为
,结合信息可知F为CH2=CH-C(CH3)=CH2,G与H互为同分异构体,则G为 .乙醇系列转化得到F,则乙醇与氧气发生催化氧化得到A为CH3CHO,由信息可知B为CH3CH(OH)CH(CH3)2,B发生消去反应得到C与D,C与溴发生加成反应得到E,E发生消去反应得到F,则D为CH2=CHCH(CH3)2,C为CH3CH=C(CH3)2,E为(CH3)2CBrCHBrCH3,据此解答.
.乙醇系列转化得到F,则乙醇与氧气发生催化氧化得到A为CH3CHO,由信息可知B为CH3CH(OH)CH(CH3)2,B发生消去反应得到C与D,C与溴发生加成反应得到E,E发生消去反应得到F,则D为CH2=CHCH(CH3)2,C为CH3CH=C(CH3)2,E为(CH3)2CBrCHBrCH3,据此解答.
解答 解:由α-松油醇的结构、给予的反应信息,逆推可知H为 ,结合信息可知F为CH2=CH-C(CH3)=CH2,G与H互为同分异构体,则G为
,结合信息可知F为CH2=CH-C(CH3)=CH2,G与H互为同分异构体,则G为 .乙醇系列转化得到F,则乙醇与氧气发生催化氧化得到A为CH3CHO,由信息可知B为CH3CH(OH)CH(CH3)2,B发生消去反应得到C与D,C与溴发生加成反应得到E,E发生消去反应得到F,则D为CH2=CHCH(CH3)2,C为CH3CH=C(CH3)2,E为(CH3)2CBrCHBrCH3.
.乙醇系列转化得到F,则乙醇与氧气发生催化氧化得到A为CH3CHO,由信息可知B为CH3CH(OH)CH(CH3)2,B发生消去反应得到C与D,C与溴发生加成反应得到E,E发生消去反应得到F,则D为CH2=CHCH(CH3)2,C为CH3CH=C(CH3)2,E为(CH3)2CBrCHBrCH3.
(1)由上述分析可知,试剂1是O2,试剂2是Br2,故答案为:O2;Br2;
(2)含有醛基的物质可以发生有机反应,A至H中能发生银镜反应的是:CH3CHO,故答案为:CH3CHO;
(3)D的结构简式为CH2=CHCH(CH3)2,G的结构简式为 ,
,
故答案为:CH2=CHCH(CH3)2; ;
;
(4)E转化为F的化学方程式是(CH3)2CBrCHBrCH3+2NaOH$→_{△}^{醇}$CH2=CH-C(CH3)=CH2+2NaBr+2H2O,
故答案为:(CH3)2CBrCHBrCH3+2NaOH$→_{△}^{醇}$CH2=CH-C(CH3)=CH2+2NaBr+2H2O;
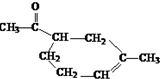
(5)F转化为H的化学方程式是: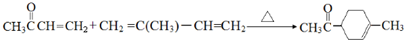 ,
,
故答案为: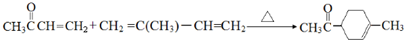 .
.
点评 本题考查有机物的推断与合成,根据有机物的结构与反应信息采取正逆推法相结合进行推断,需要学生熟练掌握官能团的结构与性质,较好的考查学生自学能力、知识迁移运用,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 反应后溶液可能呈中性 | |
| B. | 反应停止后一定有固体剩余 | |
| C. | 反应过程中一定有氧化还原反应发生 | |
| D. | 若只有Cu剩余,向溶液中滴入铁氰化钾溶液不会产生蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验装置 | 编号 | 溶液X | 实验现象 |
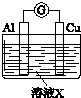 | 实验Ⅰ | 6mol•L-1稀硝酸 | 电流计指针向右偏转,铜片表面产生无色气体,在液面上方变为红棕色. |
| 实验Ⅱ | 15mol•L-1浓硝酸 | 电流计指针先向右偏转,很快又偏向左边,铝片和铜片表面产生红棕色气体,溶液变为绿色. |
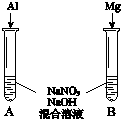 (3)用如图装置进行实验Ⅲ:溶液X为1mol•L-1稀硝酸溶液,观察到电流计指针向右偏转.
(3)用如图装置进行实验Ⅲ:溶液X为1mol•L-1稀硝酸溶液,观察到电流计指针向右偏转.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 实验操作 | 实验现象 |
| 实验1 | 向2mL 0.001mol/L NaHCO3溶液中加入1mL 0.1mol/LCaCl2溶液 | 无明显变化.用激光笔照射,没有出现光亮的通路. |
| 实验2 | 向2mL 0.1mol/L NaHCO3溶液中加入1mL 0.1mol/LCaCl2溶液 | 略显白色均匀的浑浊,用激光笔照射,出现光亮的通路. |
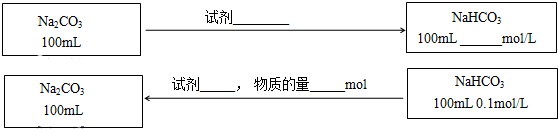
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Fe+4H2O═Fe2O3+4H2 | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | Ca(OH)2+SO2═CaSO3+H2O | D. | Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com