
| A. | 用10ml量筒量取7.5ml稀盐酸 | |
| B. | 用托盘天平称取25.20gNaCl晶体 | |
| C. | 用蒸发结晶的方法由硫酸铜溶液制取蓝帆 | |
| D. | 用100ml容量瓶配置0.5mol/l的Na2CO3溶液 |
分析 A.10mL量筒的最小读数为0.1mL;
B.托盘天平只能读到0.1,无法称量出0.01g氯化钠;
C.蒸发结晶无法得到含有结晶水的蓝帆;
D.可以用100mL的容量瓶配制0.5mol/L的碳酸钠溶液.
解答 解:A.规格为10mL的量筒的最小读数为0.1mL,可用10mL量筒量取7.5mL稀盐酸,故A正确;
B.托盘天平的最小读数为0.1g.无法用托盘天平称取25.20gNaCl晶体,故B错误;
C.需要通过蒸发浓缩、冷却结晶、过滤得到硫酸铜晶体,不能直接蒸发结晶,故C错误;
D.可以用规格为100mL的容量瓶配制0.5mol/L的碳酸钠溶液,故D正确;
故选AD.
点评 本题考查了化学实验方案的评价,题目难度不大,明确常见化学实验基本操作方法为解答关键,注意掌握常见仪器的构造及使用方法,试题培养了学生的化学实验能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH2CH2OH | B. | (CH3)2COHCH2CH3 | ||
| C. | (CH3)2CHCH2CH2OH | D. | (CH3)3CCH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
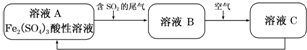
| A. | 向B溶液中滴加KSCN溶液,溶液不会变为血红色 | |
| B. | 溶液B转化为溶液C发生的变化的离子方程式为4H++2Fe2++O2═2Fe3++2H2O | |
| C. | 溶液酸性A>B>C | |
| D. | 加氧化亚铁可以使溶液C转化为溶液B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取气体时,先装药品,后检查装置的气密性 | |
| B. | 加热KClO3并用排水法收集O2实验结束时,先熄灭酒精灯,后移出导管 | |
| C. | 稀释浓硫酸时,先把浓硫酸倒入烧杯中,后沿器壁缓慢注入水,边加边搅拌 | |
| D. | 加热试管时,先使试管底部均匀受热,后用酒精灯的外焰固定加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4(aq)+Ba (OH)2(aq)═BaSO4(s)+2H2O(l)△H=-114.6 kJ•mol-1 | |
| B. | 2KOH(aq)+H2SO4(aq)═K2SO4(aq)+2H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | C (s,石墨)+O2(g)═CO2(g)△H=-393.5kJ•mol-1 | |
| D. | C (s,石墨)+$\frac{1}{2}$O2(g)═CO (g)△H=-393.5kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝能置换出氧化铁中的铁,钢铁工业利用铝热反应冶炼铁 | |
| B. | 用铝制容器盛放浓硝酸,是因为铝和浓硝酸不反应 | |
| C. | 明矾溶于水生成氢氧化铝胶体,起消毒杀菌的作用 | |
| D. | 因为液态氨气化时吸热,可用液态氨作制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com