
【题目】实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知 Fe3+在 pH=5时沉淀完全).其中分析错误的是
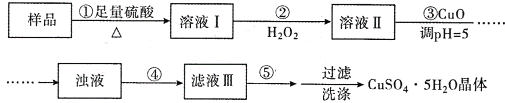
A. 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
B. 步骤②不能用氯水、硝酸等强氧化剂代替H2O2
C. 步骤③用 CuCO3代替CuO也可调节溶液的pH
D. 步骤④为过滤,步骤⑤蒸发结晶
【答案】D
【解析】
样品中含有FeO、Fe2O3和CuO,加入足量硫酸后,固体溶解转化为Cu2+,Fe2+,Fe3+,加入过氧化氢溶液后,亚铁离子氧化为Fe3+,调节pH=5,铁离子沉淀为氢氧化铁,过滤,蒸发浓缩,冷却结晶后得到胆矾晶体。
A. 步骤②中亚铁离子与过氧化氢在酸性环境下发生反应2Fe2++H2O2+2H+=2Fe3++2H2O,A正确;
B. 步骤②若用氯水、硝酸等强氧化剂代替H2O2,会引入氯原子、硝酸根新的杂质,不利于胆矾的回收,同时造成环境污染,B正确;
C. 步骤③用 CuCO3代替CuO也可调节pH,碳酸铜与硫酸反应产生硫酸铜,二氧化碳和水,不会引入新的杂质,C正确;
D. 步骤④为过滤,步骤⑤为蒸发浓缩,冷却结晶,D错误;
答案为D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切联系.下列有关说法正确的是( )
A.目前研究菠菜蛋白质“发电”不属于“太阳能文明”
B.二氧化硫有毒,禁止用作葡萄酒添加剂
C.燃料电池是利用燃料在电池中燃烧实现热能转化为电能
D.太阳能电池可将太阳能直接转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是( )

A. 工业生产常选用NaOH作为沉淀剂
B. 粗盐可采用除杂和重结晶等过程提纯
C. 向苦卤中通入Cl2是为了提取溴
D. 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知a、b、c的分子式均为C4H8O2,其结构简式如下图所示,下列说法正确的是
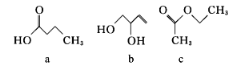
A. a、b均能使酸性KMnO4溶液褪色 B. a、b、c均可与氢氧化钠溶液反应
C. a、b、c中只有b的所有原子处于同一平面 D. c的二氯代物有六种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语使用正确的是
A. 核内质子数为117、中子数为174的核素Ts可表示为:![]()
B. 甲烷分子的比例模型: ![]()
C. COCl2的结构式为:![]()
D. H2O2的电子式为:H+[ ![]() ]2-H+
]2-H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】查阅资料知:Br2的沸点为58.8 ℃,密度为3.119 g·cm-3,微溶于水,有毒。
Ⅰ.(1)常温下,单质溴通常呈________态,保存时通常在盛溴的试剂瓶中加入少量________。
Ⅱ.工业生产中,海水提取溴常用热空气吹出法。其生产流程如下:

某化学实验小组模拟该法设计了如下实验装置(夹持装置略去)从浓缩的海水中提取液溴。实验步骤如下:
①关闭活塞b、d,打开活塞a、c,向A中缓慢通入Cl2至反应结束;
②关闭a、c,打开b、d,向A中鼓入足量热空气;
③关闭b,打开a,再通过A向B中通入足量的Cl2;
④将B中所得液体进行蒸馏,收集液溴。

(2)当观察到A中液面上方出现________(实验现象)时即可判断步骤①中反应已经结束。
(3)X试剂可以是________(填字母,下同),尾气处理选用________。
a.H2O b.饱和食盐水 c.氢氧化钠溶液 d.饱和Na2SO3溶液
B中X试剂发生反应的离子方程式为________________________________。
(4)蒸馏时应该选择______(填序号),操作中应控制的关键实验条件为____________。

Ⅲ.该实验小组利用制得的单质溴研究H2与Br2生成HBr的反应,实验装置如下:

(5)E装置可用来检验反应产物HBr,则D装置的作用是_______。若要检验E中收集的HBr,图示装置检验HBr还不够完善,请结合原有实验装置予以改进:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1mL1.00mol·L-1HCl溶液和V2mL未如浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )

A. 做该实验时环境温度为22℃ B. 该实验表明化学能可以转化为热能
C. NaOH溶液的浓度约为1.00mol·L-1 D. 该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在强碱性溶液中能大量共存的是
A.Mg2+、Na+、NO3-、SO42-B.Na+、K+、ClO-、I-
C.Na+、K+、HCO3-、SO42-D.Ba2+、Na+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如下图所示,由图中数据分析得:
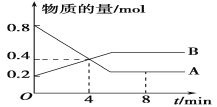
①该反应的化学方程式为____________________;
②反应开始至4 min时,B的平均反应速率为________ ,A的反应速率为_____ ,A的转化率为_____。
③4 min时,反应是否达到平衡状态?________(填“是”或“否”),8 min时,v(正)________v(逆)(填“>”、“<”或“=”)。
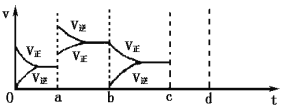
(2)下图表示在密闭容器中反应:2SO2(g) + O2(g)![]() 2SO3(g)△H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a时改变的条件可能是______________;b时改变的条件可能是______________。
2SO3(g)△H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a时改变的条件可能是______________;b时改变的条件可能是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com