
【题目】铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒。工业上往往采取下列循环工艺防止铬的污染:
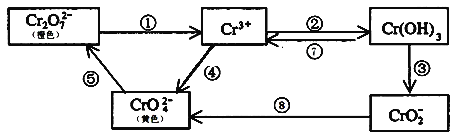
完成下列填空:
(1)①步中含Cr2O![]() 离子的废水在酸性条件下能用Fe3O4处理,反应的离子方程式为_____________;
离子的废水在酸性条件下能用Fe3O4处理,反应的离子方程式为_____________;
(2)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:___________________________________;
(3)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:
①Cr2O72-+6I-+14H+ =3I2+2Cr3++7H2O
②2S2O32-+ I2 =S4O62-+2I-,准确称取纯净的K2Cr2O7 0.294g配成溶液,加足量KI,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。
①回收所得的Cr(OH)3在处理之前需要先进行洗涤,洗涤沉淀的方法为________________________;
②滴定时加入的指示剂通常为_________,滴定至终点的现象是_______________________________;
③Na2S2O3溶液的物质的量浓度为__________。
【答案】Cr2O![]() +6Fe3O4+62H+=2Cr3++18Fe3++31H2O 2CrO42-+2H+
+6Fe3O4+62H+=2Cr3++18Fe3++31H2O 2CrO42-+2H+![]() Cr2O72-+H2O 沿玻璃棒向漏斗中注入蒸馏水,使蒸馏水完全浸没沉淀,待蒸馏水自然流尽后,重复操作2~3次 淀粉溶液 溶液的颜色由蓝色变为无色,且半分钟内溶液的颜色不再改变 0.2400mol·L-1
Cr2O72-+H2O 沿玻璃棒向漏斗中注入蒸馏水,使蒸馏水完全浸没沉淀,待蒸馏水自然流尽后,重复操作2~3次 淀粉溶液 溶液的颜色由蓝色变为无色,且半分钟内溶液的颜色不再改变 0.2400mol·L-1
【解析】
(1)①将Cr2O72-与Fe3O4反应的离子方程式配平即可;
(2)溶液由黄色逐渐变成橙色,可知是CrO42-与Cr2O72-的相互转化;
(3)①洗涤沉淀的方法为沿玻璃棒向漏斗中注入蒸馏水,使蒸馏水完全浸没沉淀,待蒸馏水自然流尽后,重复操作2~3次;②反应物为碘单质,加入淀粉做指示剂,滴定终点时溶液的颜色由蓝色变为无色,且半分钟内溶液的颜色不再改变;③Na2S2O3溶液的物质的量浓度可结合相关反应方程式进行计算;
(1)反应中Cr2O72-→Cr3+,Cr元素由+6价降为+3价,1molCr2O72-得到6e-,1molFe3O4→Fe3+失去1e-。由得失电子守恒可知,Cr2O72-的系数为1,Fe3O4的系数为6,再根据原子守恒,电荷守恒配平系数,得到离子反应方程式Cr2O72-+6Fe3O4+62H+=2Cr3++18Fe 3++31H2O;
(2)在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,说明黄色的CrO42-离子转化为Cr2O72-离子,该可逆反应的方程式为2CrO42-+2H+![]() Cr2O72-+H2O;
Cr2O72-+H2O;
(3)①洗涤沉淀的方法为沿玻璃棒向漏斗中注入蒸馏水,使蒸馏水完全浸没沉淀,待蒸馏水自然流尽后,重复操作2~3次;②反应时,碘离子被氧化为碘单质,碘遇淀粉溶液变蓝,故滴定时加入的指示剂通常为淀粉溶液;滴定至终点的现象是溶液的颜色由蓝色变为无色,且半分钟内溶液的颜色不再改变;③由Cr2O72-+6I-+14H+ =3I2+2Cr3++7H2O和2S2O32-+ I2 =S4O62-+2I-可知,Cr2O72- ~ 3I2 ~ 6S2O32-。0.294g K2Cr2O7的物质的量n(K2Cr2O7)=0.001mol,故n(Na2S2O3)=0.006mol,消耗Na2S2O3溶液25.00mL,则c(Na2S2O3)=0.2400 mol·L-1


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
阳离子 | Na+、Al3+、Ba2+、NH4+ |
阴离子 | Cl-、OH-、CO32-、SO42- |
分别取四种物质进行实验,实验结果如下①B溶液分别与C、D混合,均有白色沉淀生成②将A溶液逐滴滴入C溶液中,有沉淀生成,继续滴加A溶液时,沉淀减少直至完全消失③A与D两种固体混合有气体生成,该气体能使湿润的红色石蕊试液变蓝④用石墨电极电解B溶液,在阳极上产生一种有刺激性气味的气体
回答下列问题:
(1)A所含的阳离子和C所含阳离子的半径大小____>______(填离子符号)。B所含的阴离子是________
(2)C溶液呈___性(填“酸性”或“碱性”),其原因是__________________
(用离子方程式解释)。D的化学式是____________
(3)以Pt为电极电解1L0.1mol/LB的水溶液,当电路中通过0.1mol电子时,
溶液的pH为_______(设电解过程溶液体积不变),阳极的电极反应式为 _____
(4)若将④阳极产生的气体通入A溶液中至恰好完全反应时,则溶液中各离子
浓度由大到小的排列顺序为__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图所示装置检验草酸亚铁晶体(FeC2O4·2H2O,淡黄色)受热分解的部分产物。下列说法正确的是( )
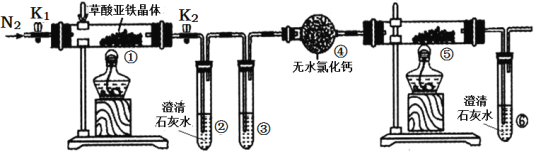
A. 通入N2的主要目的是防止空气中的水蒸气对产物检验产生影响
B. 若③和⑤中分别盛放足量NaOH溶液、CuO固体,可检验生成的CO
C. 实验结束后,①中淡黄色粉末完全变成黑色,则产物一定为铁
D. 若将④中的无水CaC12换成无水硫酸铜可检验分解生成的水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应与能量有着密不可分的关系,回答下列问题:
A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的稀硫酸
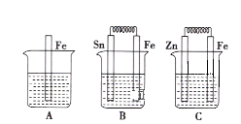
(1)分别写出三个装置中铁片表面发生反应的离子方程式或电极反应式:A._________________________;B.________________________________________;C.____________________;
(2)一段时间后,C中产生了3.36L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸的物质的量浓度为__________mol·L-1。三个烧杯全部反应完之后,三个烧杯中液体质量由大到小的顺序为__________(填写序号)。
(3)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是__________(填写序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从煤和石油中可以提炼出化工原料A和B,A是一种果实促熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳、氢两种元素组成,碳元素与氢元素的质量比为12∶1,B的相对分子质量为78。回答下列问题:
(1)A的电子式为____________________,A的结构简式为____________________。
(2)A可以使溴的四氯化碳溶液褪色的化学反应方程式为: _________,反应类型为__________。
(3)在碘水中加入B振荡静置后的现象为___________________。
(4)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式为: ___________,反应类型为__________。
(5)等质量的A、B完全燃烧时消耗O2的物质的量__________(填"A>B""A<B"或"A=B")。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有下列几组物质:A. ![]() B. 丙烷和己烷 C. 正丁烷和异丁烷 D. CH3CH3和CH3(CH2)8CH3
B. 丙烷和己烷 C. 正丁烷和异丁烷 D. CH3CH3和CH3(CH2)8CH3
E.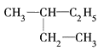 和
和![]() F.
F.![]() 和
和![]()
其中,①属于同分异构体的是________;②属于同位素的是________;③属于同一种物质的是________;
④属于同系物的是________________;
(2)已知某烷烃分子相对分子质量为72。
①该烷烃的分子式为______________;
②写出该烷烃分子所有的同分异构体的结构简式____________________________;
③上述同分异构体中,在相同条件下沸点最低的是_____________________________(写结构简式);
(3) 已知![]() 的苯环上的二氯取代物有6种,则甲苯苯环上的三氯取代物有______种;
的苯环上的二氯取代物有6种,则甲苯苯环上的三氯取代物有______种;
(4)下列各种醇不能发生催化氧化的是_______ 。
A. CH3OH B. CH3CH2OH C. CH3CH(CH3)OH D. CH3CH2C(CH3)2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10L的固定容器中发生的反应:N2+3H2![]() 2NH3,反应过程如下图所示,下列说法正确的是
2NH3,反应过程如下图所示,下列说法正确的是
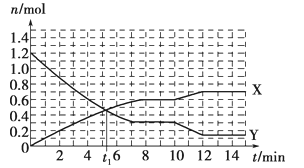
A. t1 min时正、逆反应速率相等
B. X曲线表示NH3的物质的量随时间变化的关系
C. 0~8 min,H2的平均反应速率v(H2)=0.75 mol·L-1·min-1
D. 10~12 min,N2的平均反应速率为v(N2)=0.25mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
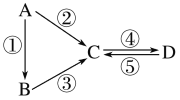
(1)若A是淡黄色固体,C、D是氧化物,C是造成酸雨的主要物质,但C也有其广泛的用途,写出其中的两个用途:____,写出④的化学方程式___________________ 。若将C通入酸性高锰酸钾溶液中,溶液褪色,则C表现_______性。在同温同压下,若将C和氯气按体积比为1:1通入品红溶液中,会观察的现象为_______,用离子方程式表示其原因____________________________________________。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,则该反应化学方程式_______________,写出③的化学方程式:__________________。
(3)若A是太阳能电池用的光伏材料,B可用作光导纤维,C、D为钠盐。写出②反应的化学方程式:________________________。C的水溶液俗名为是________,其必须密封保存,其原因为______________________________(用化学方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com