
【题目】某学习小组用下图装置研究Cl2的性质。
| 序号 | X | 实验现象 |
Ⅰ | AgNO3溶液 | 现象a | |
Ⅱ | 淀粉碘化钾溶液 | 溶液变蓝 | |
Ⅲ | 紫色石蕊溶液 | 溶液先变红后褪色 | |
Ⅳ | Na2SO3溶液 | 无明显现象 |
请回答:
(1)实验Ⅰ中,现象a是______。
(2)根据实验Ⅱ,推断Cl2的化学性质是______。
(3)根据实验Ⅲ,结合化学方程式说明产生现象的原因:______。
(4)实验Ⅳ中无现象,如何证明反应发生了,简述实验方案______。
(5)结合离子方程式说明实验中NaOH溶液的作用是______。
【答案】 白色沉淀 氧化性 Cl2+H2O ![]() HCl+HClO ,盐酸具有酸性,能使紫色石蕊溶液变红;次氯酸具有强氧化性(或漂白性),能使石蕊溶液褪色 取反应后溶液,向其中先滴加盐酸,使溶液呈酸性,再滴加氯化钡溶液,若有白色沉淀生成,则证明氯气和亚硫酸钠溶液发生了反应 尾气吸收,Cl2+2OH-
HCl+HClO ,盐酸具有酸性,能使紫色石蕊溶液变红;次氯酸具有强氧化性(或漂白性),能使石蕊溶液褪色 取反应后溶液,向其中先滴加盐酸,使溶液呈酸性,再滴加氯化钡溶液,若有白色沉淀生成,则证明氯气和亚硫酸钠溶液发生了反应 尾气吸收,Cl2+2OH- ![]() Cl-+ClO-+H2O
Cl-+ClO-+H2O
【解析】(1)根据氯气具有强氧化性,溶于水生成盐酸和次氯酸以及氯气属于大气污染物结合问题分析解答。
(1)氯气通入硝酸银溶液中生成氯化银白色沉淀,所以实验Ⅰ中,现象a是产生白色沉淀。
(2)溶液变蓝,说明有单质碘生成,这是由于氯气具有强氧化性,把碘化钾氧化为单质碘,碘遇淀粉显蓝色。
(3)氯气溶于水发生反应Cl2+H2O=HCl+HClO,盐酸具有酸性,能使紫色石蕊溶液变红;次氯酸具有强氧化性(或漂白性),能使石蕊溶液褪色,所以氯气通入紫色石蕊试液中溶液先变红后褪色。
(4)氯气能把亚硫酸钠氧化为硫酸钠,可以通过检验硫酸根离子证明反应发生了,即取反应后溶液,向其中先滴加盐酸,使溶液呈酸性,再滴加氯化钡溶液,若有白色沉淀生成,则证明氯气和亚硫酸钠溶液发生了反应。
(5)氯气有毒,属于大气污染物,需要尾气处理,发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的N2,排尽装置内的空气。

已知:在溶液中.FeSO4+NO![]() [Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法不正确的是
[Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法不正确的是
A. 装置F、I中的试剂依次为水、硫酸亚铁溶液
B. 若观察到装置H中红色粉末变黑色,则NO与Cu发生了反应
C. 实验结束后,先熄灭酒精灯,再关闭分液漏斗的活塞
D. 装置J收集的气体中一定不含NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用Na2CO3和NaHCO3溶液进行如图所示实验。下列说法中,正确的是
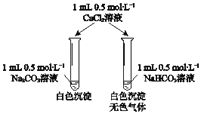
A. 实验前两溶液的pH相等 B. 实验前两溶液中离子种类完全相同
C. 加入CaCl2溶液后生成的沉淀一样多 D. 反应的离子方程式都是CO32-+Ca2+═CaCO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用地壳中某主要元素生产的多种产品在现代高科技中占有重要位置,足见化学对现代物质文明的重要作用.例如:计算机芯片的主要成分是________;光导纤维的主要成分是________; 人们使用量最大的传统硅酸盐产品有水泥、玻璃和________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体:
①D的化学式是________;
②在工业生产中,B气体的大量排放被雨水吸收后形成了________而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体:
①A、C的化学式分别是:A________;C________。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式_______________________________________________。该反应________(填“属于”或“不属于”)氧化还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作错误的是( )
A. 可用托盘天平和小烧杯称取 10.2 g NaOH固体
B. 某实验需要 900 mL 0.1 mol/L的硫酸铜溶液,则配制该溶液需称取 22.5 g 胆矾晶体
C. 用 10 mL 量筒量取 5.2 mL 硫酸,仰视时实际量得的液体体积大于 5.2 mL
D. 在配制一定物质的量浓度溶液的定容步骤时,俯视凹液面,所配溶液浓度偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国本土科学家屠呦呦因为发现青蒿素而获得2015年的诺贝尔生理和医学奖.已知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( ) 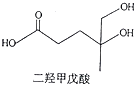
A.与乙醇发生酯化反应生成产物的分子式为C8H18O4
B.能发生加成反应,不能发生取代反应
C.在铜的催化下与氧气反应的产物可以发生银镜反应
D.标准状况下1mol该有机物可以与足量金属钠反应产生22.4L H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将ag铁和氧化铁的混合物加入800mL0.1mol/L 的盐酸中充分反应后,盐酸全部消耗,放出标准状兄下气体0.224L。则下列判断中正确的是 ( )
A. 原混合物中n (Fe) :n (Fe2O3) =2: 1 B. 向溶液中滴入KSCN 溶液,显血红色
C. 无法计算出原混合物的质量 D. 此混合物中铁元素的质量分数为68.6%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出8种元素在元素周期表中的位置,结合所学内容回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)写出①的元素符号_________, 元素⑥的原子结构示意图____________________。
(2)写出元素⑤的最高价氧化物对应的水化物的电子式_____________, 该化合物中含有的化学键是_____________________。
(3)H元素分别与②、③、④形成的最稳定的气态氢化物是______________(写氢化物的化学式)。
(4)⑦、⑧是两种常见的非金属元素,从原子结构分析,原子半径⑦_______⑧(填写“>”或“<”);得电子能力较强是________ (填写元素符号);非金属性强弱关系是⑦_______⑧(填写“>”或“<”);⑧的单质通入⑦的钠盐溶液中,出现黄色沉淀,其离子方程式为_________________________________。
(5)某同学阅读课外资料,看到了下列有关锗、锡、铅三种元素的性质描述:
①锗、锡在空气中不反应,铅在空气中表面形成一层氧化铅;
②锗与盐酸不反应,锡与盐酸反应,铅与盐酸反应但生成PbCl2微溶而使反应终止;
③锗、锡、铅的+4价的氢氧化物的碱性强弱顺序是:Ge(OH)4<Sn(OH)4<Pb(OH)4。
该同学查找三种元素在周期表的位置如图所示:
Ⅳ | |
4 | Ge |
5 | Sn |
6 | Pb |
请解释产生上述性质变化的原因______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com