
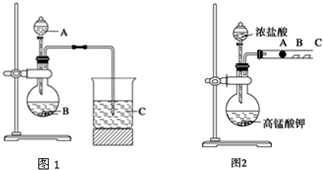
分析 实验Ⅰ:元素最高价含氧酸的酸性强弱判断元素非金属性强弱,酸性越强,非金属性越强,AB中反应是碳酸盐和高氯酸反应生成二氧化碳,证明氯非金属性大于碳;C中为Na2SiO3溶液,二氧化碳通入反应生成硅酸沉淀,证明碳的非金属性大于硅.
(1)A中反应是碳酸钙和高氯酸反应生成二氧化碳,证明氯非金属性大于碳,A为高氯酸,B为碳酸盐;
(2)C中为Na2SiO3溶液,二氧化碳通入反应生成硅酸沉淀,证明碳的非金属性大于硅;
(3)根据实验现象和元素最高价含氧酸的酸性强弱判断元素非金属性强弱,酸性越强,非金属性越强,推知Cl、N、Si三种元素非金属性的强弱.
实验Ⅱ:探究氯、溴、碘的非金属性强弱的递变规律,根据实验装置图可知,实验原理为圆底烧瓶中:浓盐酸与高锰酸钾反应生成氯气,氯气通入A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸试管,溴化钠,溶液出现红色,有溴单质生成,说明氯的非金属性强于溴,湿润的淀粉KI试纸试纸变蓝,湿润红纸褪色.
(4)圆底烧瓶中浓盐酸和高锰酸钾发生氧化还原反应生成氯化锰、氯化钾和氯气,据此书写离子方程式;
(5)溴单质、氯气和碘化钾发生置换反应生成碘单质,碘单质和淀粉显示蓝色;
(6)氯的非金属性强于碘,溴的非金属性强于碘,碘化钾处,2I-+Cl2?I2+2Cl-,2I-+Br2?I2+2Br-,不能说明Br>I.
解答 解:实验Ⅰ:(1)B中碳酸盐,可以是碳酸钙或碳酸钡或碳酸钠,和A中滴入B中的高氯酸反应生成二氧化碳,如碳酸钙反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O,根据强酸制取弱酸的原理,高氯酸的酸性强于碳酸,高氯酸、碳酸分别为Cl、C的最高价含氧酸,所以可证明氯非金属性大于碳,C中为Na2SiO3溶液,二氧化碳通入反应生成硅酸沉淀,根据强酸制取弱酸的原理,碳酸的酸性强于硅酸,碳酸、硅酸分别为C、Si的最高价含氧酸,所以可证明碳的非金属性大于硅,C装置中观察到溶液变浑浊,
故答案为:高氯酸;碳酸钙或碳酸钡或碳酸钠;
(2)C中为Na2SiO3溶液,二氧化碳通入反应生成硅酸沉淀,证明碳酸的酸性强于硅酸,少量二氧化碳和硅酸盐反应生成硅酸和碳酸钠,离子反应为:SiO32-+CO2+H2O=H2SiO3↓+CO32-,过量二氧化碳和硅酸钠反应生成硅酸和碳酸氢钠,离子反应为:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-,
故答案为:SiO32-+CO2+H2O=H2SiO3↓+CO32-(或SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-);
(3)A中反应是碳酸盐和高氯酸反应生成二氧化碳,证明高氯酸的酸性强于碳酸,C中为Na2SiO3溶液,二氧化碳通入反应生成硅酸沉淀,证明碳酸的酸性强于硅酸,所以碳酸、高氯酸、硅酸的酸性强弱顺序是高氯酸、碳酸、硅酸,根据实验现象和元素最高价含氧酸的酸性强弱判断元素非金属性强弱,酸性越强,非金属性越强,推知Cl、C、Si三种元素非金属性的强弱为Cl>C>Si,
故答案为:Cl>C>Si;
实验Ⅱ:(4)圆底烧瓶中浓盐酸与高锰酸钾反应生成氯气2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,离子反应为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,
故答案为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(5)氯的非金属性强于碘,溴的非金属性强于碘,碘化钾处,2I-+Cl2?I2+2Cl-,2I-+Br2?I2+2Br-碘单质和淀粉显示蓝色,所以B处的实验现象为试纸变蓝,
故答案为:试纸变蓝;
(6)装置中氯气也能和碘化钾发应,不一定为生成的溴和碘化钾的反应,不能说明Br>I,所以根据A、B两处的实验现象不能推出非金属性Cl>Br>I,
故答案为:否.
点评 本题考查了实验设计和实验分析的判断,主要是非金属性强弱的判断依据,掌握物质性质和实验设计是解题关键,题目难度中等,(6)装置中氯气、溴单质都能和碘化钾反应,为易错点.


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:解答题
 某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②向新制得的Na2S溶液中满加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体 |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉锭 |
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A-F) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
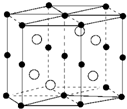
| A. | 锰价电子排布为3d74s0 | B. | Bi是d区金属 | ||
| C. | 该晶体的化学式为MnBi | D. | 该合金堆积方式是简单立方 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(A) | n(B) | n(C) | ||
| ① | 700 | 4.0 | 1.0 | 1.80 |
| ② | 800 | 1.0 | 4.0 | 1.60 |
| ③ | 800 | 2.0 | 2.0 | a |
| ④ | 900 | 1.0 | 1.0 | b |
| A. | 实验①中,若10min达到平衡,则v(D)=9.0×10-2mol/(L•min) | |
| B. | 实验②中,该反应的平衡常数K=3.2 | |
| C. | 实验③中,达到平衡时A的转化率为60% | |
| D. | 实验④中,达到平衡时,b<1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子晶体在水中溶解时,只破坏分子间作用力 | |
| B. | 原子晶体中的各相邻原子都以非极性键相结合 | |
| C. | 分子晶体的熔沸点很低,常温下都呈液态或气态 | |
| D. | 含有金属阳离子的晶体不一定是离子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,分子的立体构型为V型,中心原子的杂化轨道类型为sp3杂化.
,分子的立体构型为V型,中心原子的杂化轨道类型为sp3杂化.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com