
| A. | 原子半径:O>N>C | B. | 碱性:LiOH>NaOH>KOH | ||
| C. | 非金属性:P>S>Cl | D. | 气态氢化物稳定性:HF>HCl>H2S |
分析 A、同周期从左到右原子半径依次减小;
B、金属性越强,则对应的最高价氧化物的水化物的碱性越强;
C、同一周期,原子序数越大,非金属性越强,同一主族,原子序数越小,非金属性越强;
D、非金属性越强,气态氢化物越稳定.
解答 解:A、同周期从左到右原子半径依次减小,所以原子半径大小为C>N>O,故A错误;
B、同主族从上到下金属性依次增强,则金属性K>Na>Li,则对应的最高价氧化物的水化物的碱性为KOH>NaOH>LiOH,故B错误;
C、由于原子序数Cl>S>P,故非金属性Cl>S>P,故C错误;
D、同主族从上到下非金属性依次减弱,则非金属性F>Cl>S,所以气态氢化物的稳定性为HF>HCl>H2S,故D正确;故选D.
点评 本题考查非金属性和金属性的比较及元素周期律,熟悉非金属元素和金属元素的性质变化规律,及非金属性的比较方法即可解答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Fe3O4+4CO=3Fe+4CO2△H=-14kJ•mol-1 | |
| B. | Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=-22kJ•mol-1 | |
| C. | Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=+14kJ•mol-1 | |
| D. | Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=-14kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ②③⑤ | C. | ③④⑤ | D. | 全有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A原子最外层外层电子数比B原子最外层外层电子数少 | |
| B. | A原子电子层数比B原子电子层数多 | |
| C. | 常温时,A能从酸中置换出氢,而B不能 | |
| D. | 1molA从酸中置换生成的氢气比1molB从酸中置换生成的氢气多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
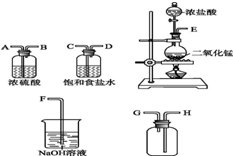 在实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
在实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30g | B. | 40g | C. | 70g | D. | 80g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
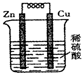
| A. | 铜片为正极,锌片为负极 | B. | 锌片溶解,质量减少 | ||
| C. | 铜片上有气泡产生 | D. | 电子由铜片经导线流向锌片 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com