
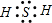 .
.分析 W是原子序数最小的元素,则W为H元素;Y和W的最外层电子数相等,则W和Y同主族,结合原子序数大小可知Y为Na元素;
Y的质子数是11,Z一定大于Y,也就是12以上,故Y和Z的和能被3整除的数有:24、27,故Z质子数为:24-11=13,或27-11=16,W的质子数是1,X的质子数有可能是7或8,故W、Z、Y、Z分别为:1,7,11,13(铝为另一种金属)不成立,或1,8,11,16 成立,所以W、X、Y、Z分别为H、O、Na、S,据此进行解答.
解答 解:①W是原子序数最小的元素,则W为H元素;Y和W的最外层电子数相等,则W和Y同主族,结合原子序数大小可知Y为Na元素;
Y的质子数是11,Z一定大于Y,也就是12以上,故Y和Z的和能被3整除的数有:24、27,故Z质子数为:24-11=13,或27-11=16,W的质子数是1,X的质子数有可能是7或8,故W、Z、Y、Z分别为:1,7,11,13(铝为另一种金属)不成立,或1,8,11,16 成立,所以W、X、Y、Z分别为H、O、Na、S,
故答案为:H;O;Na;S;
②W2Z为H2S,硫化氢属于共价化合物,只含有共价键;硫化氢的电子式为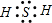 ,故答案为:共价;
,故答案为:共价;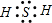 ;
;
③由X、Y、Z组成的物质为亚硫酸钠或硫酸钠,二者都是由离子键和共价键组成的离子化合物,故答案为:离子;共价;离子.
点评 本题考查了位置结构与性质关系的应用,题目难度不大,试题侧重基础知识的考查,正确推断各元素名称为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 完全由非金属组成的化合物不一定是共价化合物 | |
| B. | 构成分子晶体的粒子一定含有共价键 | |
| C. | 分子晶体的熔点一定比金属晶体的熔点低 | |
| D. | 含有金属离子的晶体一定是离子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
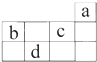
| A. | a原子的最外电子层上有8个电子 | |
| B. | c的最高价氧化物对应水化物为强酸 | |
| C. | d的原子半径比c的原子半径大 | |
| D. | b的气态氢化物比c的气态氢化物稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
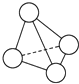 N4的分子结构类似白磷分子, 它的结构如图所示,已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中正确的是( )
N4的分子结构类似白磷分子, 它的结构如图所示,已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中正确的是( )| A. | 1 mol N4气体转变为N2将放出775 kJ热量 | |
| B. | 1 mol N4气体转变为N2将放出882 kJ热量 | |
| C. | 1 mol N4气体转变为N2将吸收775 kJ热量 | |
| D. | 1 mol N4气体转变为N2将吸收882 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 431kJ•mol-1 | B. | 945.6kJ•mol-1 | C. | 649kJ•mol-1 | D. | 896kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过导电实验证明氢氧化铁胶体带正电 | |
| B. | 除去苯中溶有的少量乙醇,加入水,振荡,然后分液 | |
| C. | 进行蒸馏操作时.应用温度计准确测量沸腾液体的温度 | |
| D. | 从海带中提取碘时用到的药品有双氧水和NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com