

分析 (1)根据氢离子移动方向知,左边电极是负极,通入燃料二甲醚,右边电极是正极,通入氧化剂氧气,该燃料电池中,正极上氧气得电子和氢离子反应生成水;
电池在放电过程中,负极上二甲醚失电子生成氢离子;
(2)①X、Y为石墨,放电时,阳极上氢氧根离子放电、阴极上氢离子放电;
②X、Y分别为铜、银,Y是阳极,阳极上银失电子发生氧化反应;
(3)室温时,按上述(2)①电解一段时间后,取25mL上述电解后溶液,滴加0.4mol/L醋酸得到图三,
①根据图知,KOH溶液的pH=13,常温下,KOH的浓度是0.1mol/L,则n(KOH)=0.1mol/L×2L=0.2mol,根据KOH和转移电子正极的关系式计算转移电子,再根据转移电子守恒计算二甲醚的质量;
②滴定终点二者恰好反应生成CH3COOK.
解答 解:(1)①根据氢离子移动方向知,左边电极是负极,通入燃料二甲醚,右边电极是正极,通入氧化剂氧气,该燃料电池中,正极上氧气得电子和氢离子反应生成水,电极反应式为O2+4e-+4H+=2H2O;故答案为:O2+4e-+4H+=2H2O;
②电池在放电过程中,b对应的电极上二甲醚失电子生成氢离子,即CH3OCH3+3H2O-12e-═2CO2+12H+;
故答案为:CH3OCH3+3H2O-12e-═2CO2+12H+;
(2)①X、Y为石墨,放电时,阳极上氢氧根离子放电、阴极上氢离子放电,所以电池反应式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
②X、Y分别为铜、银,Y是阳极,阳极上银失电子发生氧化反应,电极反应式为Ag-e-=Ag+,
故答案为:Ag-e-=Ag+;
(3)室温时,按上述(2)①电解一段时间后,取25mL上述电解后溶液,滴加0.4mol/L醋酸得到图三,①根据图知,KOH溶液的pH=13,常温下,KOH的浓度是0.1mol/L,则n(KOH)=0.1mol/L×2L=0.2mol,根据2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑知,生成0.2mol氢氧根离子转移电子的物质的量0.2mol,二甲醚燃料电池的总反应方程式是CH3OCH3+3O2=2CO2+3H2O,二甲醚转化为CO2,消耗1mol二甲醚转移电子数=2×[4-(-2)]=12mol,因此当转移0.2mol电子时消耗二甲醚的质量=$\frac{0.2mol}{12}$×46g/mol=0.77g,
故答案为:0.77;
②滴定终点二者恰好反应生成CH3COOK,KOH的浓度是醋酸的一半,则恰好中和时需要酸的体积等于KOH体积的一半,醋酸钾为强碱弱酸盐,其溶液呈碱性,当溶液的pH=7时,醋酸稍微过量,所以醋酸体积大于KOH体积的一半,所以滴定终点为AB段,故答案为:AB.
点评 本题考查了原电池和电解池原理等知识点,这些知识点都是考试热点,知道原电池和电解池中各个电极上发生的电极反应式,近几年中化学电源新型电池及燃料电池考查较多要熟练掌握基本知识,灵活运用基础知识解答问题,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 冰的密度比液态水的密度小是因为冰分子之间含有较强的化学键 | |
| B. | 氨分子的键角比甲烷分子的键角小是因为两个分子中中心原子的杂化方式不同 | |
| C. | HF的沸点比HCl的沸点高是因为HF分子内含有氢键 | |
| D. | HF比HCl稳定是因为HF分子中共价键的键能大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B两种元素可组成化学式为BA2的化合物 | |
| B. | F与D形成的化合物性质很不活泼,不与任何酸反应 | |
| C. | 原子半径由大到小的顺序是E>F | |
| D. | 气态氢化物的稳定性由强到弱的顺序是C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
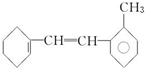 有机物结构简式如下:
有机物结构简式如下: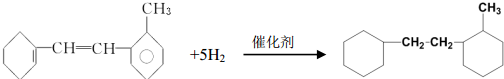 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Ba2+、NO3-、CO32- | B. | Fe2+、Na+、SO42-、MnO4- | ||
| C. | K+、Mg2+、NO3-、SO42- | D. | Na+、Fe3+、Cl-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 蒸发操作时,当混合物中的晶体大部分析出时,才能停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体也从下口放出 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com