
| A. | 硅酸钠溶液 | B. | 氯化钙溶液 | C. | 氢氧化钙溶液 | D. | 碳酸钠饱和溶液 |
分析 二氧化碳通入溶液中,如生成沉淀,可生成难溶于水的碳酸盐、碳酸氢盐,也可为酸性比碳酸弱的化合物,如硅酸、氢氧化铝等,以此解答该题.
解答 解:A.硅酸钠可以和碳酸反应生成碳酸钠和硅酸,硅酸是白色不溶于水的沉淀,故A不选;
B.碳酸酸性比盐酸弱,二氧化碳与氯化钙不反应,没有沉淀生成,故B选;
C.CO2通入澄清石灰水溶液,生成碳酸钙沉淀,故C不选;
D.碳酸钠与二氧化碳和水反应,既消耗了水,且反应生成溶解度较小的NaHCO3,所以一定有沉淀析出,故D不选.
故选B.
点评 本题综合考查了离子反应发生的条件,为高频考点,侧重考查元素化合物知识的综合理解和运用,题目难度不大,试题注重了基础知识的考查,注意明确离子反应发生的条件、掌握常见元素化合物的化学性质,选项D为易错点,注意碳酸氢钠与碳酸钠的溶解度大小.


科目:高中化学 来源: 题型:选择题
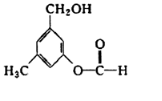 有机物A的结构简式如图所示,某同学对其可能具有的化学性质进行了如下预测,其中正确的是( )
有机物A的结构简式如图所示,某同学对其可能具有的化学性质进行了如下预测,其中正确的是( )| A. | ①②③ | B. | ①③⑤ | C. | ①②④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 酸 | H2CO3 | CH3COOH | HClO |
| K | K1=4.4×10-7;K 2=4.7×10-11 | K=1.76×10-5 | K=2.95×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B | 先滴加2滴KSCN溶液,再滴几滴新制的氯水 | 先不显红色,再滴新制的氯水后溶液变为红色 | 原溶液中有Fe2+ |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+,无K+ |
| D | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中 | 溶液变浑浊 | 原溶液中有 CO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
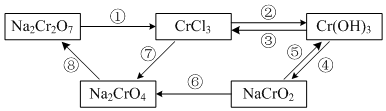
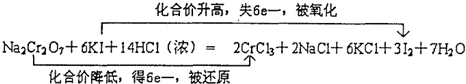
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是放热反应都是自发的,吸热反应都是非自发的 | |
| B. | 升高温度变化反应速率增大,主要原因是增加了反应物分子中活化分子百分数 | |
| C. | 一个反应的平衡常数越大,则该反应速率也越大 | |
| D. | 化学反应的实质是化学键的断裂和形成,化学反应前后化学键总数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
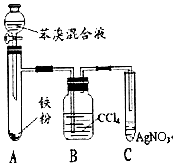 已知:溴苯不溶于水,密度1.5g/cm3,熔点-30.7℃,沸点156.2℃;苯的沸点为80.1℃.如图是制取溴苯并探究其反应类型的装置.
已知:溴苯不溶于水,密度1.5g/cm3,熔点-30.7℃,沸点156.2℃;苯的沸点为80.1℃.如图是制取溴苯并探究其反应类型的装置. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com