
| 酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡 常数 | Ka=1.75×10-5 | Ka=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
| A. | 25℃,等物质的量浓度的CH3COO-、ClO-、CO32-和SO32-,结合质子能力最强的是ClO- | |
| B. | 少量的SO2通入Na2CO3溶液中反应的离子方程式为:SO2+H2O+2CO32-═2HCO3-+SO32- | |
| C. | 少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| D. | 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-═CO32-+2HClO |
分析 弱酸的电离平衡常数越大,其酸性越强,酸的电离平衡常数H2SO3>CH3COOH>H2CO3>HSO3->HClO>HCO3-,则酸性:H2SO3>CH3COOH>H2CO3>HSO3->HClO>HCO3-,结合强酸能和弱酸盐反应制取弱酸分析解答.
解答 解:酸的电离平衡常数H2SO3>CH3COOH>H2CO3>HSO3->HClO>HCO3-,则酸性:H2SO3>CH3COOH>H2CO3>HSO3->HClO>HCO3-,
A.酸性:CH3COOH>H2CO3>HSO3->HClO>HCO3-,则酸性越强,对应离子结合质子能力越弱,则结合质子能力最强的为CO32-,故A错误;
B.酸性:H2SO3>H2CO3>HSO3-,所以少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-═SO32-+2HCO3-,故B正确;
C.二氧化硫具有还原性,次氯酸根离子具有氧化性,二者能发生氧化还原反应生成硫酸根离子和氯离子,所以少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++ClO-=CaSO4↓+Cl-+2H+,故C错误;
D.H2CO3>HClO>HCO3-,所以少量的CO2通入NaClO溶液中碳酸氢根离子和次氯酸,正确的离子方程式为:CO2+H2O+ClO-═HCO3-+HClO,故D错误;
故选B.
点评 本题考查弱电解质的电离、盐类的水解、氧化还原反应等知识点,注意二氧化硫能被次氯酸根离子氧化生成硫酸根离子,注意盐类水解程度大小的比较方法,为易错点,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠与水反应:Na+H2O═Na++H2 | |
| B. | 氯化铵溶液显酸性的原因:NH4++H2O═NH3•H2O+H+ | |
| C. | AICl3溶液中加入足量氨水:Al3++4NH3•H2O═AlO2-+4NH4+2H2O | |
| D. | 氯化铁溶液中滴加少量的硫化氢溶液:2Fe3++H2S═2Fe2++S+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
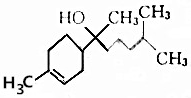
| A. | 分子式为C15H26O | B. | 能和NaHCO3溶液反应生成CO2 | ||
| C. | 不能使酸性高锰酸钾溶液褪色 | D. | 能与乙酸发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M>N | B. | M<N | C. | M=N | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水时,当溶液pH由7变为13,电路中转移的电子数为0.1NA | |
| B. | 标准状况下,35.5 g 氯气与足量红热的铁充分反应得到的电子数一定为NA | |
| C. | 标准状况下,2.24 L HF中含有的原子数为0.2NA | |
| D. | 在密闭容器中加入0.5 moL N2和1.5 moL H2,充分反应后容器中的N-H键数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 预期现象与结论 |
| 步骤1:将适量稀H2SO4加入少许样品于试管中,加热溶解; | 溶液呈黄绿色,说明溶液中可能含Fe2+和Fe3+. |
| 步骤2:取少量溶液,滴 加0.01mol/L的KMnO4溶液. | 若紫红色不褪去,则说明催化剂中含铁元素的价态+3价;若紫红色褪去, 则说明催化剂中含有铁元素的价态为+2价 |
| 步骤3:另取少量溶液,滴 加20%的KSCN溶液. | 若溶液变为血红色,则说明催化剂中含铁元素的价态+3价;若溶液无变化,则说明催化剂中含铁元素的价态+2价; |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCl2 的物质的量浓度为0.5mol•L-1 | |
| B. | Cl-的个数为3.01×1023 | |
| C. | Mg2+的物质的量为2mol | |
| D. | Cl-的物质的量浓度为2mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com