
【题目】解释下列反应原理的离子方程式正确的是
A. 用加热的方法降低自来水中钙离子浓度:Ca2++2HCO3-![]() CaCO3↓+H2O+CO2↑
CaCO3↓+H2O+CO2↑
B. 向CH2BrCOOH中加入足量的NaOH溶液并加热:CH2BrCOOH+OH-→CH2BrCOO-+H2O
C. 向Mg(HCO3)2溶液中加入足量的NaOH溶液:Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+H2O
D. 在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知pOH=-lgc(OH-)。T℃时,往50mL0.1mol·L-1MOH溶液中滴加0.1mol·L-1盐酸,溶液pH、pOH随滴入盐酸体积的变化如下图所示,以下说法正确的是
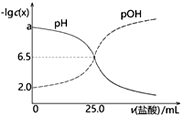
A. 盐酸与MOH溶液恰好中和时溶液pH=6.5
B. a=12
C. 盐酸滴定MOH实验中选择酚酞做指示剂比选甲基橙误差更小
D. T℃时,MOH的电离平衡常数Kb约为1.0×10-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X和Y形成能够离子化合物XY2。且该离子化合物中阴、阳离子具有相同的电子层结构。下列说法不正确的是( )
A.离子半径:X2+<Y-
B.原子序数:X<Y
C.该化合物中只存在离子键
D.原子最外层电子数X<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
A. 工业制硫酸采用二氧化硫催化氧化,高温可以提高单位时间SO3的产量
B. 合成氨工业中使用铁触媒做催化剂
C. 用饱和食盐水除去氯气中氯化氢杂质
D. 容器中有2HI(g)![]() H2(g)+I2(g),增大压强颜色变深
H2(g)+I2(g),增大压强颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、G、M六种元素位于元素周期表前四周期,原子序数依次增大。其中,元素A的一种核素无中子,B的单质既有分子晶体又有原子晶体,化合物DE2为红棕色气体,G是前四周期中电负性最小的元素,M的原子核外电子数比G多10。
请回答下列问题:
(1)基态G原子的核外电子排布式是___________,M在元素周期表中的位置是_______,元素B、D、E的第一电离能由大到小的顺序为______________________(用元素符号表示)。
(2)元素A和E组成的阳离子空间构型为__________________________;化合物ABD的结构式为____________,其中B原子的杂化方式为____。

(3)G、M的晶体晶胞结构如图所示,这两种晶胞中原子的配位数之比为___________。若晶体M密度为8.9g·cm-3,则M的晶胞边长是____________________cm(不必计算出结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AG均分别代表一种物质,结合如图所示的转化关系(框图中的部分产物已略去),回答下列问题:

已知:I.天然有机高分子化合物A,是一种遇到碘水能变蓝的多糖;
Ⅱ. H为丙三醇(CH2OH-CHOH-CH2OH),G有香味。
(1)①C→E的反应类型为_________。
②与出D→C的化学反应方程式:_________。
③写出F与H以物质的量3:1浓硫酸、加热条件下发生的化学方程式:_____。
(2)人在剧列运动后腿和胳膊会感到酸胀或疼痛,原因之一是B(C6H12O6)→2C3H6O3(乳酸)。某研究小组为了研究乳酸(无色液体,与水混溶)的性质,做了如下实验:
①取90g乳酸饱和NaHCO3溶液反应,测得生成的气体体积为22.4L(标准状况下);
②另取90g乳酚与过量的金属钠反应,测得生成的气体体积为22.4L(标准状况下)。
由以上实验推知乳酸分子含有的官能团名称________;试写出所有符合上述条件有机物的同分异构体的结构简式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同的方式投入反应物,发生反应 N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol,测得反应的相关数据如下表:
2NH3(g) △H=-92.4kJ/mol,测得反应的相关数据如下表:
容器甲 | 容器乙 | 容器丙 | |
反应温度/℃ | 400 | 400 | 500 |
反应物投入量 | 1molN2,3molH2 | 4molNH3 | 1molN2,3molH2 |
平衡时v(正)(H2)/mol/(Ls) | v1 | v2 | v3 |
平衡时c(NH3)/(mol/L) | c1 | c2 | c3 |
平衡时总压强P/Pa | P1 | P2 | P3 |
物质的平衡转化率a | a1(N2) | a2(NH3) | a3(N2) |
平衡常数K | K1 | K2 | K3 |
下列关系正确的是
A. v1<v2,c1<2c2 B. c2>2c3,a2(NH3)+a3(N2)<1
C. K1>K3, P2>2P3 D. v1<v3,a1(N2)<a3(N2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均是短周期元素,其原子序数依次增大,A和B同周期,A和D同主族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与C的阳离子电子层结构相同,C的单质与B的单质在不同条件下反应,可生成C2B或C2B2,E是所在周期中原子半径最小的元素。请回答:
(1)D在元素周期表中的位置是 。
(2)C2B的电子式是 ;AB2的结构式是 。
(3)B、C、E的离子半径由大到小的顺序为 (用化学式回答,下同);A、D、E元素最高价氧化物对应水化物的酸性由强到弱为 。
(4)B的气态氢化物与H2S相比沸点高的是 (用化学式回答);原因是 。
(5)水中锰含量超标,容易使洁具和衣物染色,使水产生异味,EB2可以用来除去水中超标的Mn2+,生成黑色沉淀MnO2,当消耗13.50gEB2时,共转移了1mol电子,则反应的离子方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com