
【题目】(1)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。其正极反应方程式为____________,若将负极材料改为CH4,写出其负极反应方程式___________。
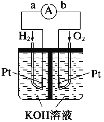
(2)NH3代替氢气研发燃料电池是当前科研的一个热点。使用的电解质溶液是2 mol·L-1的KOH溶液,电池总反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为__________;每消耗3.4g NH3转移的电子数目为_________。
【答案】O2 + 2H2O + 4e- = 4OH- CH4 + 10OH- - 8e- =![]() + 7H2O 2NH3 + 6OH- -6e- =N2 + 6H2O 0.6NA
+ 7H2O 2NH3 + 6OH- -6e- =N2 + 6H2O 0.6NA
【解析】
在原电池中,负极上失电子,燃料发生氧化反应,正极上得电子,氧气发生还原反应。
(1)氢氧燃料电池正极上氧气得电子,发生还原反应,电解质是碱,则生成OH-,反应式为:O2 + 2H2O + 4e- = 4OH-,若将负极材料改为CH4,在碱性条件下应该生成![]() ,总反应式为:CH4 +2O2+2OH- =
,总反应式为:CH4 +2O2+2OH- =![]() +3H2O,正极反应为:2O2 + 4H2O + 8e- = 8OH-,两式相减得负极反应方程式为:CH4 + 10OH- - 8e- =
+3H2O,正极反应为:2O2 + 4H2O + 8e- = 8OH-,两式相减得负极反应方程式为:CH4 + 10OH- - 8e- =![]() + 7H2O;
+ 7H2O;
(2) NH3代替氢气,电解质溶液是KOH溶液没有变,则正极反应式也没有变化,电池总反应为:4NH3+3O2=2N2+6H2O,正极反应为:3O2 + 6H2O + 12e- = 12OH-,两式相减得负极反应方程式为:4NH3 + 12OH- -12e- =2N2 + 12H2O,即为2NH3 + 6OH- -6e- =N2 + 6H2O;3.4g NH3物质的量为:![]() ,根据负极反应可知,2mol NH3转移6mol电子,则3.4g NH3转移的电子数目为0.6 mol,即0.6NA。
,根据负极反应可知,2mol NH3转移6mol电子,则3.4g NH3转移的电子数目为0.6 mol,即0.6NA。


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
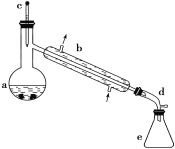
可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
合成反应:在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓H2SO4,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是__________。
(2)本实验中最容易产生的副产物的结构简式为_______。
(3)在本实验分离过程中,产物应该从分液漏斗的_______(填“上口倒出”或“下口放出”)。
(4)分离提纯过程中加入无水氯化钙的目的是______。
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有____(填正确答案标号)。
A 圆底烧瓶 B 温度计 C 吸滤瓶 D 球形冷凝管 E 接收器
(6)以下区分环己烯精品和粗品的方法,合理的是______。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国土地面积的1/5受到重金属的污染。镉盐因溶解度高,在水中多以离子状态存在,对水生植物的影响尤为严重。某科研小组研究不同浓度的锅对水生植物紫萍生理的影响,结果见图。对实验数据分析时发现MDA(膜脂分解最重要的产物之一)的含量与镉浓度呈正相关。请回答下列问题。
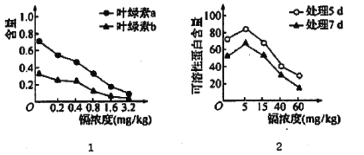
(1)由图I可知,该实验的自变量为____,由图I得出的结论是________________。
(2)可溶性蛋白含量是衡量植物总体代谢的重要指标。生物学上可以用______试剂检测可溶性蛋白,会产生________色的络合物。
(3)由MDA含量与镉浓度的关系可推测:镉可能是通过破坏______(结构)影响________反应阶段,降低光合速率;同时也可能通过破坏______(结构)影响有氧呼吸第三阶段的进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)。已知反应过程中的某一时间SO2、O2和SO3的浓度分别为:0.2mol/L、0.1mol/L和0.2mol/L。当反应达到平衡时可能存在的数据正确的是
2SO3(g)。已知反应过程中的某一时间SO2、O2和SO3的浓度分别为:0.2mol/L、0.1mol/L和0.2mol/L。当反应达到平衡时可能存在的数据正确的是
A.c(O2)=0.2mol/LB.c(SO2)=0.25mol/L
C.c(SO3)=0.4mol/LD.c(SO2)=c(SO3)=0.15mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,向容积为2 L 的密闭容器甲、乙中分别充入一定量的CO(g)和H2O(g),发生反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
容器 | 甲 | 乙 | ||
反应物 | CO | H2O | CO | H2O |
起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
A. 甲容器中,平衡时,反应放出的热量为16.4 kJ
B. T1时,反应的平衡常数K甲 = 1
C. 平衡时,乙中CO的浓度是甲中的2倍
D. 乙容器中,平衡时CO的转化率约为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向某浓度的二元弱酸H2C2O4溶液中逐滴加入NaOH溶液,pC与溶液pH的变化关系如图所示(pC=-lgx,x表示溶液中溶质微粒的物质的量浓度)。下列说法正确的是
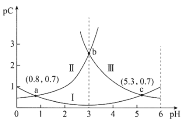
A.常温下,H2C2O4的Ka1=100.8
B.pH=3时,溶液中![]()
C.pH由0.8增大到5.3的过程中,水的电离程度逐渐增大
D.常温下,随着pH的增大,![]() 的值先增大后减小
的值先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 互为同分异构体,下列说法不正确的是
互为同分异构体,下列说法不正确的是
A. z的二氯代物有三种
B. x、y的一氯代物均只有三种
C. x、y、z中只有x的所有原子可能处于同一平面
D. x、y 可使溴的四氯化碳溶液因发生加成反应而褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbCl2是一种重要的化工材料,常用作助溶剂、制备铅黄等染料。工业生产中利用方铅矿精矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbCl2的工艺流程如下图所示。
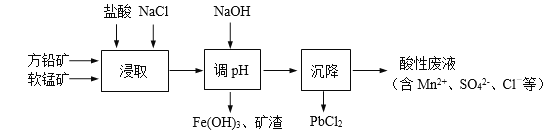
已知:i. PbCl2微溶于水
ii. PbCl2 (s) + 2Cl-(aq) ![]() PbCl42-(aq) ΔH > 0
PbCl42-(aq) ΔH > 0
(1)在浸取前矿石样品要粉碎,目的是___________。
(2)浸取过程中MnO2与PbS发生如下反应,请将离子反应方程式配平:
__+__+PbS+__MnO2=PbCl2+______+_______+__
(3)由于PbCl2微溶于水,容易附着在方铅矿表面形成“钝化层”使反应速率大大降低,浸取剂中加入饱和NaCl溶液可有效避免这一现象,原因是_______________。
(4)调节pH的目的是_________________。
(5)调节pH过滤后的滤液进入沉降池,从滤液中获得PbCl2(s)可以采取的措施有_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应4NH3+5O2![]() 4NO+6H2O(g),下列叙述不正确的是 ( )
4NO+6H2O(g),下列叙述不正确的是 ( )
A.达到平衡时,4v(O2)正=5v(NO)逆
B.达到平衡状态后,NH3 、O2 、NO 、H2O(g)的物质的量保持不变。
C.达到平衡状态时,若增加容器体积,则反应速率增大
D.若单位时间生成xmolNO的同时,生成xmolNH3,则反应达到平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com