
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
请回答下列有关含氮 物质的问题:
物质的问题:
(1)右图是1molNO2和1molCO反应生成CO2 和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式_____________________________________;
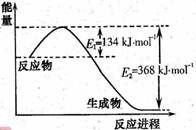
恒温恒容条件下,不能说明该反应已达到平衡状态的是___(填序号)。
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.v逆(NO2)=v正(NO)
D.容器内混合气体密度保持不变
(2)汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g)+O2(g) 2NO(g) ΔH>0,已知该反应在2404℃ 时,平衡常数K=64×10-4。
2NO(g) ΔH>0,已知该反应在2404℃ 时,平衡常数K=64×10-4。
该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol/L、4.0×10-2 mol/L和3.0×10-3 mol/L,此时反应_______(填“处于化学平衡 状态”、“向正反应方向进行”或“向逆反应方向进行”)。
状态”、“向正反应方向进行”或“向逆反应方向进行”)。
(3)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。总电池反应为N2H4+O2 = N2+2H2O。该电池放电时,负极的电极反应式是_________。
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出盐酸肼第一步水解反应的离子方程式_____________________________________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届黑龙江大庆实验中学高三上学期期中考试化学试卷(解析版) 题型:选择题
某温度下将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-的物质的量浓度之比为3:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
A.2:1 B.4:3 C.1:3 D.3:1
查看答案和解析>>
科目:高中化学 来源:2015-2016安徽蚌埠第二中学高二上学期期中考试化学试卷(解析版) 题型:选择题
下列变化中,属于化学变化的是( )
①橡胶的老化②油脂的硬化 ③石油的裂化 ④蛋白质的盐析
A.①②③④B.只有②③C.只有①③D.只有①②③
查看答案和解析>>
科目:高中化学 来源:2016届辽宁沈阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列物质转化在给定条件下能实现的是( )
① 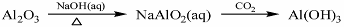
② 
③ 
④ 
A.①③ B.③④ C. ②④ D. ①④
查看答案和解析>>
科目:高中化学 来源:2016届湖南师范大学附属中学高三上月考(四)化学试卷(解析版) 题型:简答题
(12分) ClO2气体是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒。但二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。
(1)欧洲国家主要采用氯酸钠氧化浓盐酸制备ClO2,缺点主要是产率低,产品难以分离,还产生毒副产品。该反应的化学反应方程式为: 。科学家又研究出了一 种新的制备ClO2的方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为 ,此法提高了生产及储存、运输的安全性,原因是 。
(2)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg/L之间。碘量法可以检测水中ClO2的浓度,步骤如下:
I.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2 S2 O3溶液.(已知:2S2O32-+I2=S4O62-+2I-)
III.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如下图所示。
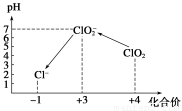
请回答:
①操作I中反应的离子方程式是 。
②在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式 是 。
是 。
③若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10一3mol/L的Na2S2O3溶液10 mL,则水样中ClO2的浓度是 mg/L。
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三第三次月考理综化学试卷(解析版) 题型:实验题
肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O)。
CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl
实验一: 制备NaClO溶液(实验装置如图所示)

(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有 (填标号)
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)锥形瓶中发生反应化学程式是 。
(3)利用中和滴定反应原理测定反应后锥形瓶中混合溶液的NaOH的浓度。取一定量锥形瓶内混合溶液稀释一定倍数后,加入适量的H2O2溶液后,再滴加2-3滴甲基橙试液,用0.100mol/L盐酸滴定。需要加入H2O2除去ClO-的原因是 。
实验二: 制取水合肼。(实验装置如图所示)

控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108-114℃馏分(已知:N2H4·H2O易被NaClO氧化,高温易分解)
(4)分液漏斗中的溶液是 (填标号)。
A.CO (NH2) 2溶液 B.NaOH和NaClO混合溶液
选择的理由是 。
蒸馏时需要减压,原因是 。
实验三: 测定馏分中肼含量。
称取馏分5.000g,加入适量NaHCO3固体,加水配成1000mL溶液,移出10.00mL,用?0.1000mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。
滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是能与在滴定过程中产生的 反应。
(6)实验测得消耗I2溶液的平均值为16.40mL,馏分中水合肼(N2H4·H2O)的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2016届河北正定中学高三上学期期中考试化学试卷(解析版) 题型:选择题
80 ℃时,2 L 密闭容器中充入0.40 mol N2O4,发生反应N2O4 2NO2 ΔH=+Q kJ·mol-1(Q>0),获得如下数据:
2NO2 ΔH=+Q kJ·mol-1(Q>0),获得如下数据:
时间/s | 0 | 20 | 4 | 60 | 80 | 100 |
c(NO2)/mol·L | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
下列判断正确的是( )
A.升高温度该反应的平衡常数K减小
B.20~40 s 内,v(N2O4)=0.004 mol·L-1·s1
C.反应达平衡时,吸收的热量为0.30 Q kJ
D.100 s 时再通入0.40 mol N2O4,达新平衡时N2O4的转化率增大
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三12月月考化学试卷(解析版) 题型:选择题
已知:2H2(g)+O2(g) ===2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g) ===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1 
H﹢(aq)+OH﹣(aq) ===H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
A.H2(g)的燃烧热为142.9kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热 量多
量多
C.H2SO4(aq)+1/2Ba(OH)2(aq)=1/2 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g) ===CH3OH(l)+H2O(l) ΔH=+131.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016届辽宁葫芦岛第一高级中学高三上期中考试化学试卷(解析版) 题型:选择题
将一定量的Cl2通入一定浓度的苛性钠溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如下图。下列说法不正确的是 ( )
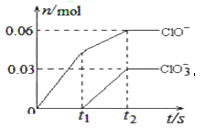
A.苛性钠溶液中NaOH的物质的量是0.09mol
B.ClO3—的生成与通入氯气的量的多少无关
C.反应中转移电子的物质的量是0.21mol
D.在酸性条件下ClO-和Cl-可生成Cl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com