
| A. | 工业上用电解熔融氯化镁制单质镁 | |
| B. | 工业上用电解饱和食盐水制氯气 | |
| C. | 工业上用二氧化硅在高温下与焦炭反应制得高纯度的硅 | |
| D. | 工业上炼铁时,常用石灰石除去铁矿石中的SiO2 |
分析 A.工业上用电解熔融氯化镁的方法制取镁;
B.用电解饱和食盐水制氯气,氢离子和氯离子放电;
C.生成一氧化碳和粗硅;
D.高炉炼铁时,使用石灰石的目的是:将矿石中的二氧化硅转变为炉渣,即除去脉石(SiO2).
解答 解:A.工业上用电解熔融氯化镁的方法制取镁,可用于工业生产,故A正确;
B.用电解饱和食盐水制氯气,氢离子和氯离子放电,可用于工业生产,故B正确;
C.二氧化硅和与碳在高温下发生置换反应,生成一氧化碳和粗硅,得不到高纯度硅,故C错误;
D.炼铁时,石灰石中的碳酸钙在高温条件下分解能生成氧化钙和二氧化碳,氧化钙能和二氧化硅反应生成硅酸钙,从而除去铁矿石中的二氧化硅,可用于工业生产,故D正确.
故选C.
点评 本题考查了有关化学工艺的一些知识,掌握从海水中提取金属镁原理、氯气制备原理、制取高纯硅的原理以及工业炼铁除去铁矿石中的脉石方法原理是解答的关键,题目难度中等.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:解答题

| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可能由pH=2的盐酸与pH=12的氨水等体积混合而成 | |
| B. | 该溶液可能由等物质的量浓度的盐酸和氨水等体积混合而成 | |
| C. | 加入适量氨水,溶液中离子浓度可能为:c (NH4+)>c (Cl-)>c (OH-)>c(H+) | |
| D. | 该溶液中c (NH4+)=c (Cl-)+c (OH-)-c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
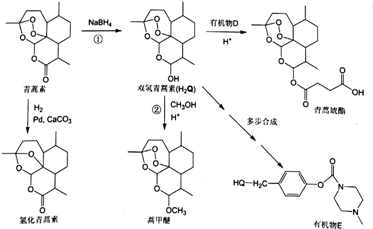
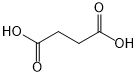 (或
(或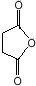 ).
). .
.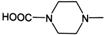 外,还需含苯环的二羟基化合物P,其结构简式为
外,还需含苯环的二羟基化合物P,其结构简式为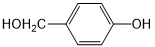 .化合物S是P的同分异构体,其分子结构含有苯环,有4种不同类型的氢,且个数比为3:2:2:1,写出S的一种结构简式
.化合物S是P的同分异构体,其分子结构含有苯环,有4种不同类型的氢,且个数比为3:2:2:1,写出S的一种结构简式 (或
(或 ,其他合理答案亦可).
,其他合理答案亦可).查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置甲中铜片表面产生气泡 | |
| B. | 装置甲溶液中SO42ˉ向铜片做定向移动 | |
| C. | 装置乙中电子从铜片经导线流向锌片 | |
| D. | 装置乙中正极的电极反应式:2H++2eˉ═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制一定物质的量浓度的溶液,向容量瓶加水至液面离刻度线1~2 cm时,改用胶头滴管定容 | |
| B. | 向某溶液中先加入Ba(NO3)2溶液,再加入足量的HNO3溶液,产生白色沉淀,则该溶液中一定含有SO42- | |
| C. | 分液操作时,将下层液体先放出,然后关闭旋塞,将上层液体从上口倒出 | |
| D. | 将油脂与氢氧化钠溶液混合充分反应后,再加入热的饱和食盐水,则可析出肥皂的主要成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
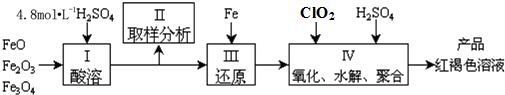
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃、30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO32-+2H2O?H2CO3+2OH- | |
| D. | 纯水的电离方程式:H2O+H2O?H3O++OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com