
科目:高中化学 来源: 题型:
镁、铝混合粉末10.2g,将它溶于500mL4mol·L-的盐酸里,若要使沉淀质量达到最大值,则需加入2mol·l-1的氢氧化钠溶液的体积为 ( )
A.1000mL B.500mL C.100mL D.1500mL
查看答案和解析>>
科目:高中化学 来源: 题型:
某校学习小组进行下述实验,探究CH3COOH、H2CO3和H2SiO3
(H2SiO3是一种难溶于水的弱酸,呈白色)的酸性强弱顺序:CH3COOH>H2CO3>H2SiO3。该校学生设计了如图的实验装置(夹持仪器已略去):
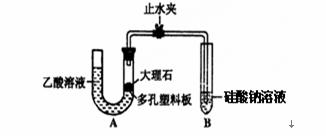
(1) 某学生检查装置A的气密性时,先关闭止水夹,从左管向U型管内加水,至左管液面高于右管液面,静置一段时间后,若U型管两侧液面差不发生变化,则气密性良好。你认为该学生的操作正确与否? (填“正确”或“错误”),大理石与乙酸溶液反应的离子方程式为: 。
(2) 试描述能证明三种酸的酸性强弱的现象 。
(3) 有学生认为上述现象不足以证明H2CO3的酸性比H2SiO3强,理由是乙酸有挥发性,挥发出的CH3COOH也可以和Na2SiO3溶液反应,生成H2SiO3。改进该装置的方法是在装置A和B之间连一个盛有饱和 溶液(选
填Na2CO3、NaHCO3或Na2SiO3)的洗气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式不正确的是 ( )
A.向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
B .在亚硫酸中加入过量的次氯酸钠溶液:H2SO3+ClO-=Cl-+2H++SO
.在亚硫酸中加入过量的次氯酸钠溶液:H2SO3+ClO-=Cl-+2H++SO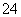
C.在碳酸氢镁溶液中加入过量氢氧化钠溶液:
Mg2++2HCO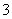 +4OH-=Mg(OH)2 ↓+2CO
+4OH-=Mg(OH)2 ↓+2CO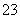 +2H2O
+2H2O
D.在过氧化钠中加入稀硫酸:2Na2O2+4H+=4Na++2H2O+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、X均为常见的纯净物,它们之间有如下转化关系(副产品已略去 )。
)。
 |
试回答:
(1)若X是强氧化性单质,则A不可能是 。
 a. S b. N2 c. Na d. Mg e. Al
a. S b. N2 c. Na d. Mg e. Al
 (2)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀,检验此C溶液中金属元素价态的操作方法是: 。则B的化学式为 。
(2)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀,检验此C溶液中金属元素价态的操作方法是: 。则B的化学式为 。
(3)若A、B、C为含某金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,B为两性化合物,则X的化学式可能为(写出不同类物质) 或 ,
反应①的离子方程式为(写一条) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
结合下图判断,下列叙述不正确的是 (把两容器中电解质溶液连通形成回路)
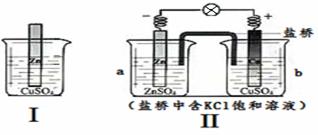
A.Ⅰ、Ⅱ的反应原理均是Zn + Cu2+ = Zn2+ + Cu
B. Ⅰ、Ⅱ中均有电子转移,均是把化学能转化为电能
C. 随着反应的进行,Ⅰ、Ⅱ中CuSO4溶液颜色均渐渐变浅
D. 取a中溶液,加足量Ba(NO3)2溶液,过滤后向滤液中加AgNO3溶液,有沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分,有关说法的组合中正确的是
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 2 | a | b | |||||
| 3 | d | e | f | g | h | i |
①a、b、e、f四种元素原子半径:e > f > b > a ②h、i两种元素阴离子的还原性:h > i
③a、g两种元素氢化物稳定性:a > g ④d、e、f最高价氧化物对应水化物碱性依次增强
⑤八种元素中d元素的单质还原性最强,i元素的单质氧化性最强
A.①③④ B.②③⑤ C.②④⑤ D.①③⑤
| …… |
查看答案和解析>>
科目:高中化学 来源: 题型:
把1.0 mol X和1.0 mol Y气体混合于2 L的密闭容器中,发生如下反应:
2X(g)+Y(g) 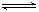 nZ(g) +2W(g)
nZ(g) +2W(g)
已知2min末,生成0.4 mol W,以Z的浓度表示的反应速率为0.1mol/(L·min)。
(1)前2min以X的浓度表示的平均反应速率为 。
(2)2min末时Y的浓度为
(3)n= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
铜的冶炼过程大致可分为:
①富集,将硫化物矿进行浮选
②焙烧,主要反应为:
2CuFeS2+4O2===Cu2S+3SO2+2FeO(炉渣)
③制粗铜,在1200℃发生的主要反应为:2Cu2S+3O2===2Cu2O+2SO2;2Cu2O+Cu2S===6Cu+SO2↑
④电解精炼铜
下列说法正确的是( )
A.冶炼过程中的尾气可用来制硫酸
B.上述过程中,由1 mol CuFeS2制取1 mol Cu时共消耗2 mol O2
C.在反应2Cu2O+Cu2S===6Cu+SO2↑中,氧化剂是Cu2O和Cu2S
D.电解精炼铜的过程中,每转移1 mol电子时,阳极溶解铜的质量为32 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com