
【题目】现有金属单质A、B、C、I和气体甲、乙、丙及物质D、E、F、G、H。其中B是地壳中含量最多的金属。它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
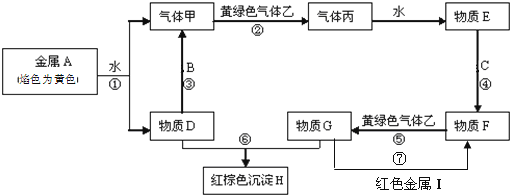
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:C__________、H_________。
(2)写出反应③的化学方程式:___________________。
写出反应⑦的化学方程式:___________________。
写出反应⑥的离子方程式___________________。
【答案】Fe Fe(OH)3 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 2FeCl3+Cu=2FeCl2+CuCl2 Fe3++3OH﹣=Fe(OH)3↓
【解析】
金属单质A焰色反应为黄色,故A为Na,与水反应生成NaOH与氢气,则D为NaOH,气体甲为H2;B是地壳中含量最多的金属,氢氧化钠与金属B反应生成氢气,故金属B为Al。黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸。氢氧化钠与物质G反应生成红褐色沉淀H是Fe(OH)3,故物质G中含有Fe3+,金属C与盐酸反应生成F,F与氯气反应生成G,可知金属C为Fe,物质F为FeCl2,物质G为FeCl3,红色金属I为Cu。
(1)根据分析可知,C为Fe,H为Fe(OH)3。
(2)根据分析可知,反应③是Al和NaOH溶液反应生成H2,化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;反应⑦是FeCl3溶液和Cu反应,化学方程式为:2FeCl3+Cu=2FeCl2+CuCl2;G为FeCl3,和NaOH反应的离子方程式为:Fe3++3OH﹣=Fe(OH)3↓。


 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列为元素周期表中的一部分,用化学式或元素符号回答下列问题。
族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
二 |
|
| ||||||
三 |
|
|
|
|
|
| ||
四 |
(1)9种元素中,化学性质最不活泼的是______,原子结构示意图为____________。
(2)这些元素中,最高价氧化物的水化物中碱性最强的碱是__________,写出元素![]() 的单质与其反应的离子方程式:___________________________________。
的单质与其反应的离子方程式:___________________________________。
(3)最高价氧化物是两性氧化物的元素是______ ,写出它的氧化物与NaOH溶液反应的化学反应方程式: ____________________________________ 。
(4)用电子式表示元素![]() 和
和![]() 组成的化合物的形成过程 _____________________________,该化合物属于 ______ (填“共价”或“离子”
组成的化合物的形成过程 _____________________________,该化合物属于 ______ (填“共价”或“离子”![]() 化合物。
化合物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硫酸铜晶体结晶水含量测定的实验中,会造成实验结果偏低的是( )
A. 加热时间过长,固体部分变黑B. 坩埚内附有不挥发杂质
C. 晶体不纯,含有不挥发杂质D. 加热过程中有少量晶体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实一定能说明HF是弱酸的是( )
①常温下NaF溶液的pH大于7; ②用HF溶液做导电性实验,灯泡很暗;
③HF与NaCl不能发生反应; ④常温下0.1mol/L的HF溶液的pH为2.3
⑤HF能与Na2CO3溶液反应,产生CO2气体 ⑥HF与水能以任意比混溶
⑦1mol/L的HF水溶液能使紫色石蕊试液变红
A. ①④ B. ②③⑤ C. ③④⑥ D. ①②⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图所示的是探究金属腐蚀条件的实验装置图,请分析实验并回答下列问题:

(1)若起始时甲、乙、丙3套装置的导管中液面高度相同,过一段时间后液面最高的是________。
(2)通过甲、乙装置的对比说明钢铁中碳的含量越________(填“高”或“低”),钢铁越易腐蚀。
(3)乙装置中发生电化学腐蚀时正极的电极反应式为_________________________________。
Ⅱ.利用化学反应:2FeCl3+Cu=2FeCl2+CuCl2,请你选择合适的电极材料和电解质溶液,设计一个原电池。可供选择的电极材料:铁棒、铜棒、石墨棒。可供选择的电解质溶液:CuCl2溶液、FeCl2溶液、FeCl3溶液。
请填写下列空白:
(1)选择________作正极材料,________作负极材料;选择________作电解质溶液。
(2)写出有关的电极反应式:正极:__________________;负极:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对金属制品进行搞腐蚀处理,可延长其使用寿命。
(1)以下为铝村表面处理的一种方法:

①碱洗的目的是除去铝村表面的自然氧化膜,碱洗衣时候常有气泡冒出,原因是:________(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的__________。
a.NH3b.CO2c.NaOH d.HNO3
②以铝村为阳极,在H2SO4溶液中电解,铝村表面形成氧化膜,阳极电极反应式为:_____。
取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是_________。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是 。
(3)利用下图装置,可以模拟铁的电化学防护。

若X为碳棒,为减缓铁的腐蚀,开关K应该置于 处。
若X为锌,开关K置于M处,该电化学防护法称为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是以环戊烷为原料制备环戊二烯的合成路线,下列说法正确的是( )
![]()
A. ![]() 的结构简式为
的结构简式为![]()
B. 反应④的反应试剂和反应条件是浓![]() 加热
加热
C. ①②③的反应类型分别为卤代、水解、消去
D. 环戊二烯与![]() 以1∶1的物质的量之比加成可生成
以1∶1的物质的量之比加成可生成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:


图Ⅲ 铜晶体中铜原子堆积模型
(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为________________,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为__________________________________。
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是________,H3BO3晶体中B原子个数与极性键个数比为____________。
(3)金属铜具有很好的延展性、导电性、传热性,对此现象最简单的解释是用________理论。
(4)三种晶体中熔点最低的是________(填化学式),其晶体受热熔化时,克服的微粒之间的相互作用为____________________________________________________________。
(5)已知两个距离最近的Ca2+核间距离为a×10-8cm,结合CaF2晶体的晶胞示意图,CaF2晶体的密度为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
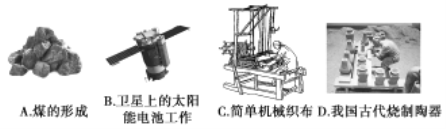
(1)下列生产、生活中的事例中没有发生氧化还原反应的是____(填写字母代号)
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”可用如图表达。
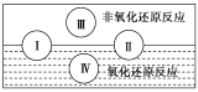
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:_____,其中水为______剂。
(3)过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O=A+NH3↑,试指出生成物A的化学式为___,并阐明H2O2被称为绿色氧化剂的理由是_______。
(4)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:____CuO+___NH4Cl![]() ____Cu+___CuCl2+___N2↑+___H2O。
____Cu+___CuCl2+___N2↑+___H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是______(填元素名称),氧化剂是____(填化学式)。
③反应中若产生0.2mol的气体,则有_____mol的电子转移。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com