
【题目】某合金X由常见的两种元素组成。为探究该合金X的元素组成和性质,设计并进行如下实验:
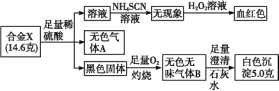
根据上述信息,回答下列问题:
(1)合金X的化学式为________。
(2)用离子方程式解释溶液中滴加H2O2后呈红色的原因:_______
(3)写出336 mL(标准状况)气体B通入100 mL 0.2 mol/L 的NaOH溶液中的化学反应方程式:_______
【答案】Fe5C H2O2+2H++2Fe2+=2Fe3++2H2O、Fe3++3SCN-=Fe(SCN)3 4NaOH+3CO2=Na2CO3+2NaHCO3+H2O
【解析】
由血红色可以推出X含有铁元素,由无色无味的气体使澄清石灰水变浑浊推出X中另一种元素为碳。铁碳合金和足量的稀硫酸反应生成FeSO4和H2(A气体),剩余黑色固体碳在足量的氧气中灼烧,生成无色无味气体B(CO2),CO2通入足量澄清石灰水中得到白色沉淀CaCO3。
(1)生成的CaCO3为5.0 g即0.05 mol,碳元素的质量为0.05 mol×12 g/mol=0.6 g,则X中铁的含量为14.6 g-0.6 g=14.0 g,即含铁14.0g÷56g/mol=0.25 mol,所以X为Fe5C。
(2)合金中的Fe与H2SO4反应生成的是FeSO4,加氧化剂H2O2后被氧化成Fe3+再与SCN-生成Fe(SCN)3。故离子方程式为:H2O2+2H++2Fe2+=2Fe3++2H2O、Fe3++3SCN-=Fe(SCN)3;
(3)CO2的物质的量为0.336L÷22.4L/mol=0.015 mol,NaOH的物质的量为0.02mol。0.015molCO2与0.02 mol NaOH反应生成Na2CO3 a mol与NaHCO3 b mol,根据Na和C守恒列2个二元一次方程分别为2a+b=0.02,a+b=0.015解得a=0.005,b=0.01,根据四种物质的最简比写出方程式:4NaOH+3CO2=Na2CO3+2NaHCO3+H2O。


科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.氯化亚铁溶液中通足量Cl2:Cl2+Fe2+=Fe3++2Cl-
B.铁与稀硝酸反应:Fe+2H+=Fe2++H2↑
C.少量的NaHCO3溶液与澄清石灰水反应:Ca2++OH-+![]() =CaCO3↓+H2O
=CaCO3↓+H2O
D.少量SO2通入到漂白粉的溶液:SO2+Ca2++2ClO-+H2O=CaSO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应X(s)+3Y(g)![]() Z(g)+2W(g),在恒容绝热容器中加入1molX和3molY发生反应,说法正确的是
Z(g)+2W(g),在恒容绝热容器中加入1molX和3molY发生反应,说法正确的是
A.在反应的过程中,加入更多的X,化学反应速率加快
B.在反应的过程中,容器内的压强变小
C.容器内温度不变时,可以说明反应到达平衡状态
D.随着反应的进行,容器内气体的密度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%,结构中有三种位置不同的氢原子。
(1)X的分子式是________;官能团名称________。
(2)X与金属钠反应放出氢气,反应的化学方程式是________________________。
(3)X与空气中的氧气在铜或银催化下反应生成Y,Y的结构简式是________;X还可以被高锰酸钾溶液直接氧化成________(填写名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林(乙酰水杨酸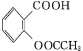 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的主要反应为
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的主要反应为
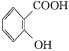 +(CH3CO)2O
+(CH3CO)2O![]()
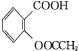 +CH3COOH
+CH3COOH
制备基本操作流程如下:
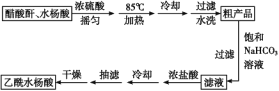
主要试剂和产品的物理常数:
名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
水杨酸 | 138 | 158(熔点) | 微溶 |
醋酸酐 | 102 | 139.4(沸点) | 反应 |
乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
请根据以上信息回答下列问题:
(1)合成过程中最合适的加热方法是__________。
(2)提纯粗产品时加入饱和NaHCO3溶液至没有CO2产生为止,再过滤,则加饱和NaHCO3溶液的目的是______
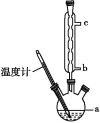
(3)另一种改进的提纯方法,称为重结晶提纯法。改进的提纯方法中加热回流的装置如图所示,仪器a的名称是____,冷凝管中冷凝水的进入口是____(填“b”或“c”),使用温度计的目的是_________
(4)检验产品中是否含有水杨酸的化学方法是_________
(5)该学习小组在实验中原料用量:2.76 g水杨酸、7.5 mL醋酸酐(ρ=1.08 g/cm3),最终称量产品m=2.92 g,则所得乙酰水杨酸的产率为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为四种溶液的溶质质量分数和物质的量浓度的数值,根据表中数据判断四种溶液中密度最小的是( )
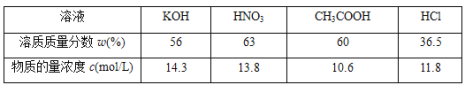
A.HClB.HNO3C.CH3COOHD.KOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2000年诺贝尔化学奖授予两位美国化学家和一位日本化学家,以表彰他们在导电塑料领域的贡献,他们首先把聚乙炔树脂制成导电塑料,下列关于聚乙炔的叙述错误的是( )
A. 聚乙炔是以乙炔为单体发生加聚反应形成的高聚物
B. 聚乙炔的化学式为![]()
C. 聚乙炔是一种碳原子之间以单双键交替结合的链状结构的物质
D. 聚乙炔树脂不加任何填充物即可成为电的良导体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低碳经济与低碳技术日益受到世界各国的关注,近年来人们尝试用CO2来合成各种有机物,以下是利用CO2合成一种不饱和内酯的反应方程式:

(1)写出CO2的结构式__________;“-R”的结构简式为____________;
(2)上述反应的反应类型为_______;若3分子R-C≡C-R也可发生类似反应,则生成有机物的结构简式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些物质的转化可用下图表示,且x,y,z都含有相同的一种元素。图示中有部分生成物未列出来
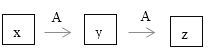
(1)①若x是AlCl3,则y的化学式是________________
②若x的阴离子含有铝元素,写出此阴离子与过量盐酸反应的离子方程式:___________________
(2)若x是一种黄绿色有毒单质气体,A是世界使用量最大的一种金属单质。
①写出A元素原子的电子排布式:__________________
②配制y的溶液,一般不是把Y的晶体溶于水,而是把y的晶体先溶解于_________(填化学式)溶液中。
③如何检验z物质中的阳离子:________________________________________________。
(3)①若x是能使湿润红色石蕊试纸变蓝的气体,该气体的中心原子轨道杂化类型是______________
②下列各组组合,不符合上图反应的是______________(填序号)
Ⅰ x: N2 A: O2 Ⅱ x: Al A: NaOH Ⅲ x: Ba(OH)2 A: CO2
Ⅳ x: S A: O2 Ⅴ x: HNO3 A: Fe Ⅵ x: SiO2 A: C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com